

Lý Thuyết Chương Halogen Hóa 10 Violet là một trong những từ khóa được tìm kiếm nhiều nhất bởi học sinh lớp 10. Bài viết này trên Đại Chiến 2 sẽ cung cấp cho bạn toàn bộ kiến thức lý thuyết về chương Halogen, bao gồm tính chất, ứng dụng và các phương pháp điều chế quan trọng, giúp bạn nắm vững kiến thức và đạt điểm cao trong các kỳ thi.
Tính Chất Vật Lý và Hóa Học của Halogen
Halogen là một nhóm các nguyên tố phi kim hoạt động mạnh, thuộc nhóm VIIA trong bảng tuần hoàn. Chúng tồn tại ở nhiều trạng thái vật lý khác nhau, từ khí (Flo, Clo) đến lỏng (Brom) và rắn (Iot, Atatin). 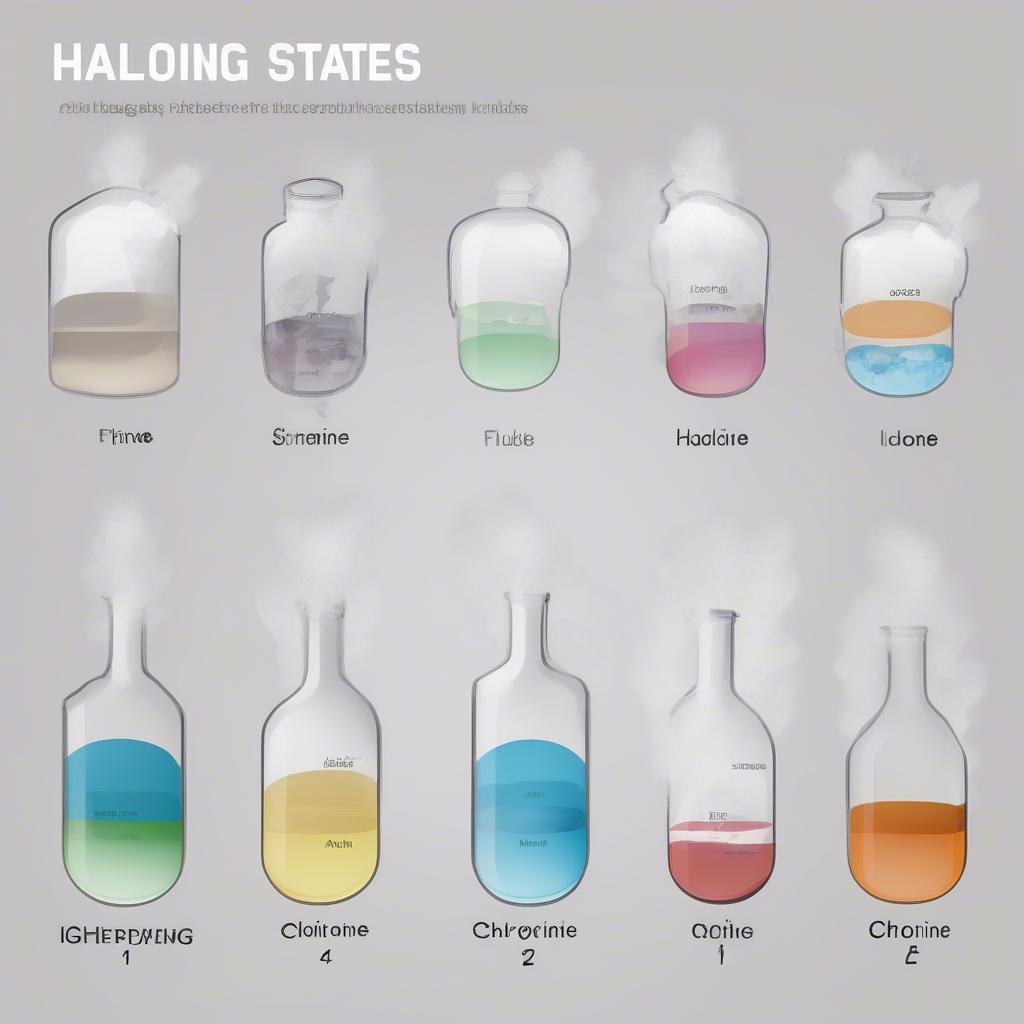 Tính chất vật lý của halogen Về mặt hóa học, halogen có tính oxi hóa mạnh, dễ dàng nhận thêm một electron để đạt cấu hình electron bền vững. Tính oxi hóa giảm dần từ Flo đến Iot. Chúng phản ứng mạnh mẽ với kim loại, hidro và nhiều phi kim khác.
Tính chất vật lý của halogen Về mặt hóa học, halogen có tính oxi hóa mạnh, dễ dàng nhận thêm một electron để đạt cấu hình electron bền vững. Tính oxi hóa giảm dần từ Flo đến Iot. Chúng phản ứng mạnh mẽ với kim loại, hidro và nhiều phi kim khác.
Phản Ứng Đặc Trưng của Halogen
- Phản ứng với kim loại: Halogen phản ứng với hầu hết các kim loại tạo thành muối halogenua. Ví dụ: 2Na + Cl₂ → 2NaCl.
- Phản ứng với hidro: Halogen phản ứng với hidro tạo thành hidro halogenua. Ví dụ: H₂ + Cl₂ → 2HCl.
- Phản ứng với nước: Clo và Brom phản ứng chậm với nước tạo thành axit halogenhidric và axit hipohalogenơ. Ví dụ: Cl₂ + H₂O ⇌ HCl + HClO.
 Phản ứng đặc trưng của halogen
Phản ứng đặc trưng của halogen
Ứng Dụng Quan Trọng của Halogen
Halogen và các hợp chất của chúng có rất nhiều ứng dụng quan trọng trong đời sống và sản xuất. Ví dụ, Clo được sử dụng để khử trùng nước, sản xuất chất tẩy trắng và nhiều hợp chất hữu cơ quan trọng. Iot được sử dụng trong y tế, sản xuất muối iot. Flo được sử dụng trong sản xuất chất dẻo Teflon. trắc nghiệm ôn tập chương 5 hóa 10
Halogen trong Đời Sống Hàng Ngày
Halogen có mặt trong nhiều sản phẩm chúng ta sử dụng hàng ngày, từ muối ăn (NaCl) đến chất chống dính trong nồi chiên (Teflon). Việc hiểu rõ tính chất và ứng dụng của halogen giúp chúng ta sử dụng chúng một cách an toàn và hiệu quả. bài thực hành số 5 môn hóa học 10
Phương Pháp Điều Chế Halogen
Halogen được điều chế bằng phương pháp điện phân dung dịch muối halogenua hoặc oxi hóa halogenua bằng các chất oxi hóa mạnh. Ví dụ, clo được điều chế bằng cách điện phân dung dịch NaCl bão hòa.
Điều Chế Clo trong Công Nghiệp
Trong công nghiệp, clo được sản xuất bằng phương pháp điện phân dung dịch NaCl bão hòa. Đây là một quá trình quan trọng cung cấp clo cho nhiều ngành công nghiệp khác nhau.  Điều chế Clo
Điều chế Clo
Kết luận
Lý thuyết chương halogen hóa 10 violet cung cấp kiến thức nền tảng về tính chất, ứng dụng và phương pháp điều chế halogen. Việc nắm vững kiến thức này sẽ giúp bạn học tốt môn Hóa học lớp 10 và đạt kết quả cao trong các kỳ thi. Hi vọng bài viết này trên Đại Chiến 2 đã cung cấp cho bạn những thông tin hữu ích. trắc nghiệm hóa 10 chương 1
FAQ
- Tại sao Flo có tính oxi hóa mạnh nhất trong nhóm Halogen?
- Ứng dụng của Brom là gì?
- Làm thế nào để điều chế Iot trong phòng thí nghiệm?
- Tại sao cần bổ sung muối iot?
- Halogen có độc hại không?
- Phản ứng đặc trưng của Clo là gì?
- Tại sao phải học lý thuyết chương Halogen?
Mô tả các tình huống thường gặp câu hỏi
Học sinh thường gặp khó khăn trong việc phân biệt tính chất của các halogen và ứng dụng của chúng. bộ đề kiểm tra hóa hk2 lớp 10 violet Việc luyện tập bài tập và làm các thí nghiệm sẽ giúp học sinh hiểu rõ hơn về chương Halogen. bài thực hành 3 hóa học 10
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về các bài tập vận dụng liên quan đến chương Halogen trên Đại CHiến 2.




