

Axit sunfuric (H2SO4) là một trong những hợp chất hóa học quan trọng nhất trong chương trình hóa 9 bài 10. Bài viết này trên Đại Chiến 2 sẽ cung cấp cho bạn kiến thức toàn diện về tính chất, ứng dụng và điều chế axit sunfuric, giúp bạn nắm vững bài 10 hóa 9 một cách dễ dàng.
Tính chất của Axit Sunfuric (H2SO4)
Axit sunfuric (H2SO4) là một axit vô cơ mạnh, tồn tại ở dạng lỏng sánh, không màu, không mùi và tan vô hạn trong nước. Khi pha loãng H2SO4 với nước, cần hết sức cẩn thận và luôn luôn cho từ từ axit vào nước, tuyệt đối không làm ngược lại do phản ứng tỏa rất nhiều nhiệt. Hóa 9 bài 10 nhấn mạnh tính chất háo nước của H2SO4 đặc.
 Tính chất của H2SO4
Tính chất của H2SO4
Tác dụng với kim loại
H2SO4 loãng tác dụng với hầu hết kim loại (trừ Pb) tạo thành muối sunfat và giải phóng khí hydro. Ví dụ: Fe + H2SO4 loãng → FeSO4 + H2. H2SO4 đặc, nóng còn tác dụng với cả những kim loại kém hoạt động như Cu, Ag tạo thành muối sunfat, nước và khí SO2.
Tác dụng với oxit bazơ
Axit sunfuric tác dụng với oxit bazơ tạo thành muối sunfat và nước. Phản ứng này được ứng dụng rộng rãi trong hóa học. Ví dụ: CuO + H2SO4 → CuSO4 + H2O.
 H2SO4 tác dụng với oxit bazơ
H2SO4 tác dụng với oxit bazơ
Tác dụng với bazơ
H2SO4 tác dụng với bazơ tạo thành muối sunfat và nước. Đây là phản ứng trung hòa điển hình. Ví dụ: 2NaOH + H2SO4 → Na2SO4 + 2H2O.
Tác dụng với muối
H2SO4 tác dụng với muối của axit yếu hơn tạo thành muối mới và axit mới. Phản ứng này thường gặp trong các bài tập hóa 9 bài 10. Ví dụ: Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2.
Ứng dụng của Axit Sunfuric (H2SO4)
Axit sunfuric có vai trò quan trọng trong nhiều ngành công nghiệp. Nó được sử dụng trong sản xuất phân bón, chất tẩy rửa, thuốc nhuộm, chất dẻo, và nhiều sản phẩm hóa học khác. Hóa 9 bài 10 cung cấp cho học sinh cái nhìn tổng quan về tầm quan trọng của axit sunfuric trong đời sống và sản xuất.
giải bài tập hóa 9 bài 10 bài 4
Điều chế Axit Sunfuric (H2SO4)
Trong công nghiệp, axit sunfuric được sản xuất bằng phương pháp tiếp xúc. Quá trình này bao gồm ba giai đoạn chính: sản xuất SO2, oxi hóa SO2 thành SO3 và hấp thụ SO3 bằng H2SO4. Bài 10 trang 72 hóa 9 thường có các bài tập liên quan đến phương pháp điều chế này.
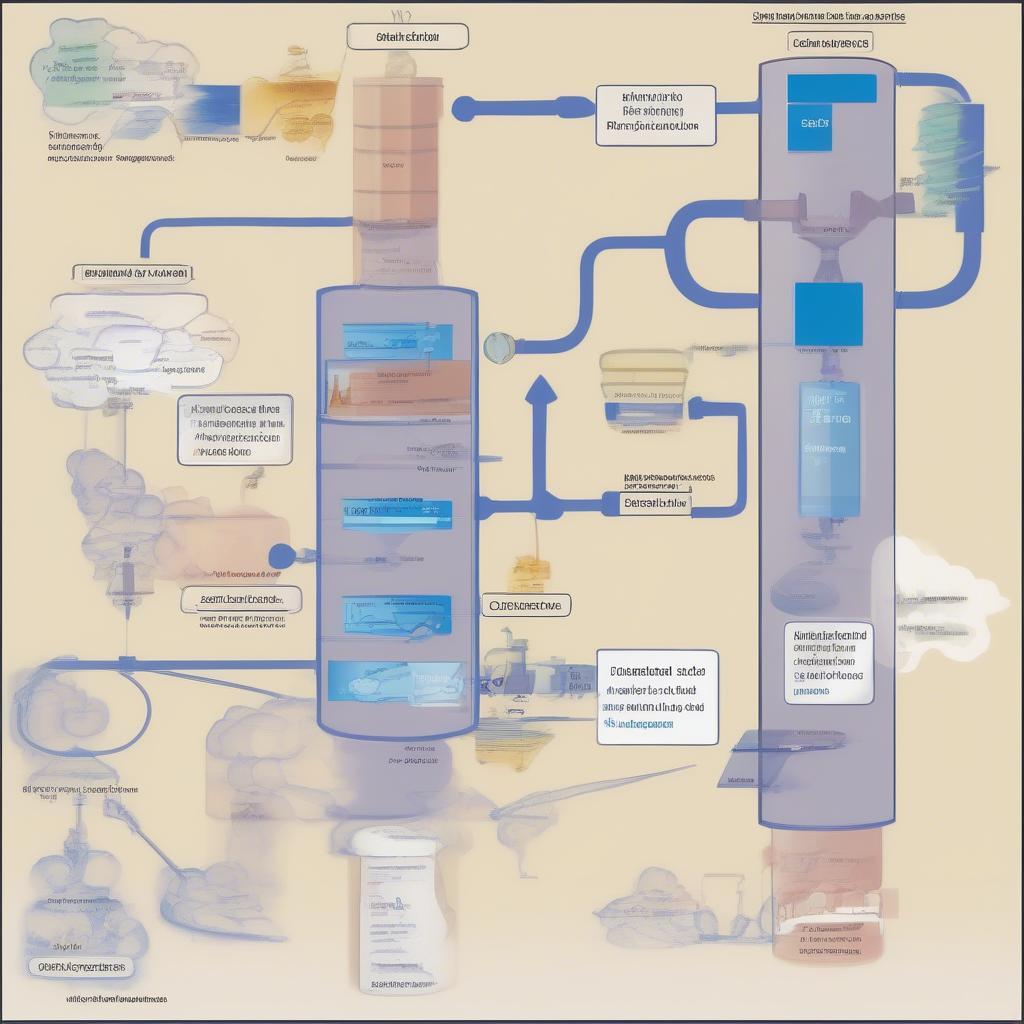 Điều chế H2SO4
Điều chế H2SO4
Kết luận
Axit sunfuric (H2SO4) là một hợp chất hóa học quan trọng với nhiều tính chất và ứng dụng. Hiểu rõ hóa 9 bài 10 về axit sunfuric sẽ giúp bạn nắm vững kiến thức cơ bản về hóa học và áp dụng vào thực tiễn. Hãy tiếp tục theo dõi Đại CHiến 2 để cập nhật thêm nhiều kiến thức bổ ích.
FAQ về Axit Sunfuric
- Tại sao phải cho axit sunfuric vào nước mà không làm ngược lại?
- Axit sunfuric có những tính chất hóa học nào?
- Ứng dụng chủ yếu của axit sunfuric là gì?
- Axit sunfuric được điều chế như thế nào trong công nghiệp?
- Tại sao axit sunfuric được coi là một hóa chất quan trọng?
- Axit sunfuric có nguy hiểm không?
- Làm thế nào để xử lý sự cố khi tiếp xúc với axit sunfuric?
Mô tả các tình huống thường gặp câu hỏi
Học sinh thường gặp khó khăn trong việc phân biệt tính chất của H2SO4 loãng và H2SO4 đặc. Ngoài ra, việc viết phương trình phản ứng của H2SO4 cũng là một vấn đề cần lưu ý. bài giảng hóa 10 bài 9
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về các axit khác tại hóa 10 bài 29 violet hoặc tìm hiểu về cách giải các bài tập nâng cao tại giải bài tập hóa 10 nâng cao bài 49.




