

Nguyên tử, đơn vị cơ bản của vật chất, luôn là một chủ đề hấp dẫn và quan trọng trong chương trình Hóa học lớp 10. Hóa 10 Bài 9 Lý Thuyết sẽ trang bị cho bạn những kiến thức nền tảng về cấu tạo nguyên tử, giúp bạn hiểu rõ hơn về thế giới vi mô và các phản ứng hóa học diễn ra xung quanh.
Cấu Tạo Nguyên Tử: Hạt Nhân và Lớp Vỏ Electron
Hóa 10 bài 9 lý thuyết tập trung vào việc giải thích cấu tạo nguyên tử, bao gồm hạt nhân và lớp vỏ electron. Hạt nhân, nằm ở trung tâm nguyên tử, chứa proton mang điện tích dương và neutron không mang điện. Lớp vỏ electron, bao quanh hạt nhân, chứa các electron mang điện tích âm. Số proton trong hạt nhân quyết định nguyên tố hóa học của nguyên tử.
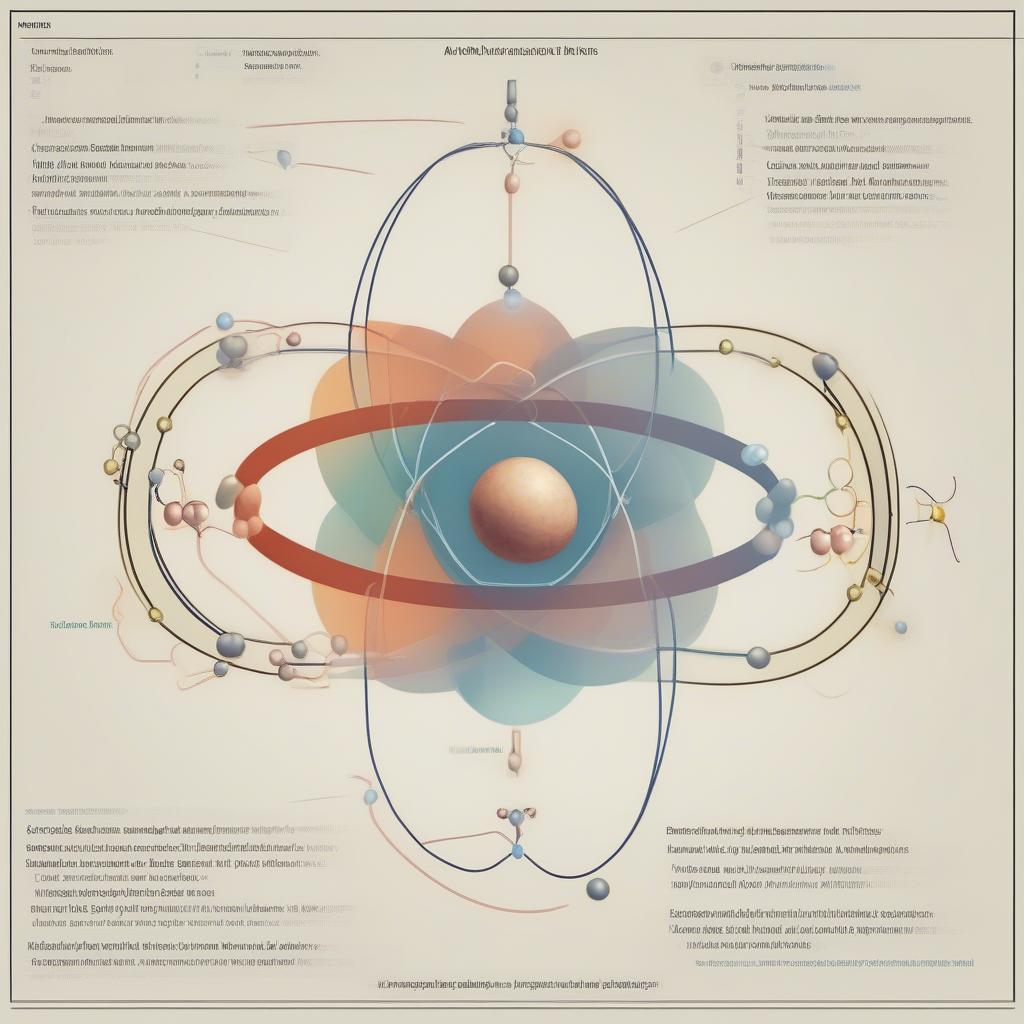 Cấu tạo nguyên tử với hạt nhân và lớp vỏ electron
Cấu tạo nguyên tử với hạt nhân và lớp vỏ electron
Sự tương tác giữa các hạt mang điện trong nguyên tử đóng vai trò quan trọng trong việc hình thành liên kết hóa học và các phản ứng hóa học. Hiểu rõ cấu tạo nguyên tử là bước đầu tiên để nắm vững các khái niệm phức tạp hơn trong hóa học.
Các Lớp Electron và Phân Lớp Electron
Hóa 10 bài 9 lý thuyết cũng giới thiệu về các lớp electron và phân lớp electron. Electron được sắp xếp thành các lớp và phân lớp theo mức năng lượng. Sự phân bố electron trong các lớp và phân lớp ảnh hưởng đến tính chất hóa học của nguyên tố.
Quy Tắc Phân Bố Electron vào các Lớp và Phân Lớp
Việc phân bố electron vào các lớp và phân lớp tuân theo một số quy tắc nhất định, bao gồm nguyên lý vững bền, nguyên lý Pauli và quy tắc Hund. Những quy tắc này giúp dự đoán cấu hình electron của các nguyên tử và từ đó suy ra tính chất hóa học của chúng.
 Phân bố electron vào các lớp và phân lớp
Phân bố electron vào các lớp và phân lớp
Ví dụ, nguyên tố Natri (Na) có 11 electron được phân bố như sau: 1s² 2s² 2p⁶ 3s¹. Cấu hình electron này cho thấy Natri dễ dàng mất đi 1 electron ở lớp ngoài cùng để đạt cấu hình bền vững, do đó Natri có tính kim loại mạnh.
Số Hiệu Nguyên Tử và Số Khối
Hóa 10 bài 9 lý thuyết cũng đề cập đến số hiệu nguyên tử (Z) và số khối (A). Số hiệu nguyên tử bằng số proton trong hạt nhân, trong khi số khối bằng tổng số proton và neutron. Hai đại lượng này giúp xác định đồng vị của một nguyên tố.
“Việc nắm vững khái niệm số hiệu nguyên tử và số khối là chìa khóa để hiểu về đồng vị và các tính chất liên quan,” theo PGS.TS Nguyễn Văn A, chuyên gia hóa học tại Đại học Bách Khoa Hà Nội.
Đồng Vị
Đồng vị là các nguyên tử của cùng một nguyên tố nhưng có số neutron khác nhau, dẫn đến số khối khác nhau. Ví dụ, Hydro có ba đồng vị: protium (¹H), deuterium (²H) và tritium (³H).
 Minh họa về đồng vị của nguyên tố Hydro
Minh họa về đồng vị của nguyên tố Hydro
Kết luận
Hóa 10 bài 9 lý thuyết cung cấp những kiến thức cơ bản về cấu tạo nguyên tử, bao gồm hạt nhân, lớp vỏ electron, số hiệu nguyên tử, số khối và đồng vị. Nắm vững những kiến thức này sẽ là nền tảng vững chắc cho việc học tập các chương tiếp theo trong chương trình Hóa học lớp 10.
FAQ về Hóa 10 Bài 9 Lý Thuyết
- Số hiệu nguyên tử là gì? Số hiệu nguyên tử (Z) là số proton trong hạt nhân của một nguyên tử.
- Số khối là gì? Số khối (A) là tổng số proton và neutron trong hạt nhân của một nguyên tử.
- Đồng vị là gì? Đồng vị là các nguyên tử của cùng một nguyên tố nhưng có số neutron khác nhau.
- Electron được phân bố như thế nào trong nguyên tử? Electron được phân bố vào các lớp và phân lớp theo mức năng lượng tăng dần.
- Tại sao việc hiểu về cấu tạo nguyên tử quan trọng? Hiểu về cấu tạo nguyên tử giúp giải thích tính chất hóa học của các nguyên tố và các phản ứng hóa học.
- Nguyên lý Pauli là gì? Nguyên lý Pauli phát biểu rằng không thể có hai electron nào trong cùng một nguyên tử có cùng bốn số lượng tử.
- Quy tắc Hund là gì? Quy tắc Hund phát biểu rằng trong một phân lớp, các electron sẽ chiếm các orbital riêng lẻ trước khi ghép đôi.
de tự luận on tập hóa 10 chương 1
đề chuyên hóa 10 ninh bình 2009-2010
Mô tả các tình huống thường gặp câu hỏi về cấu tạo nguyên tử, phân lớp electron…
Gợi ý các câu hỏi khác, bài viết khác có trong web liên quan đến bài 9 hóa 10.
Khi cần hỗ trợ hãy liên hệ Email: [email protected], địa chỉ: Mỹ Khê, Quận Hải Châu, Đà Nẵng, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.




