

Bài Tập Hóa Học Bài 1 Lớp 10 là bước khởi đầu quan trọng, giúp bạn làm quen với thế giới vi mô của các nguyên tử và phân tử. Bài viết này sẽ cung cấp cho bạn kiến thức nền tảng, phương pháp giải bài tập hiệu quả và những mẹo học tập hữu ích để chinh phục chương đầu tiên của môn Hóa học lớp 10.
 Bài tập hóa học bài 1 lớp 10: Cấu tạo nguyên tử
Bài tập hóa học bài 1 lớp 10: Cấu tạo nguyên tử
Hóa học 10 mở ra một cánh cửa mới vào thế giới vi mô của vật chất. Bài 1 lớp 10 đặt nền móng cho toàn bộ chương trình học với việc giới thiệu về nguyên tử – đơn vị cơ bản cấu tạo nên mọi vật chất xung quanh chúng ta. Nắm vững kiến thức về nguyên tử sẽ giúp bạn dễ dàng tiếp cận các bài học phức tạp hơn về phân tử, liên kết hóa học và phản ứng hóa học. Việc làm quen với bài tập hóa học bài 1 lớp 10 cũng rất quan trọng, giúp bạn rèn luyện kỹ năng tính toán và áp dụng lý thuyết vào thực tế.
Cấu Tạo Nguyên Tử: Hạt Nhân và Lớp Electron
Để giải quyết bài tập hóa học bài 1 lớp 10 hiệu quả, bạn cần nắm vững cấu tạo của nguyên tử. Nguyên tử gồm hạt nhân mang điện tích dương và các electron mang điện tích âm chuyển động xung quanh. Hạt nhân chứa proton (mang điện tích dương) và neutron (không mang điện). Số proton (ký hiệu Z) xác định nguyên tố hóa học, còn tổng số proton và neutron (ký hiệu A) là số khối. Sự sắp xếp của các electron trong các lớp electron quyết định tính chất hóa học của nguyên tố.
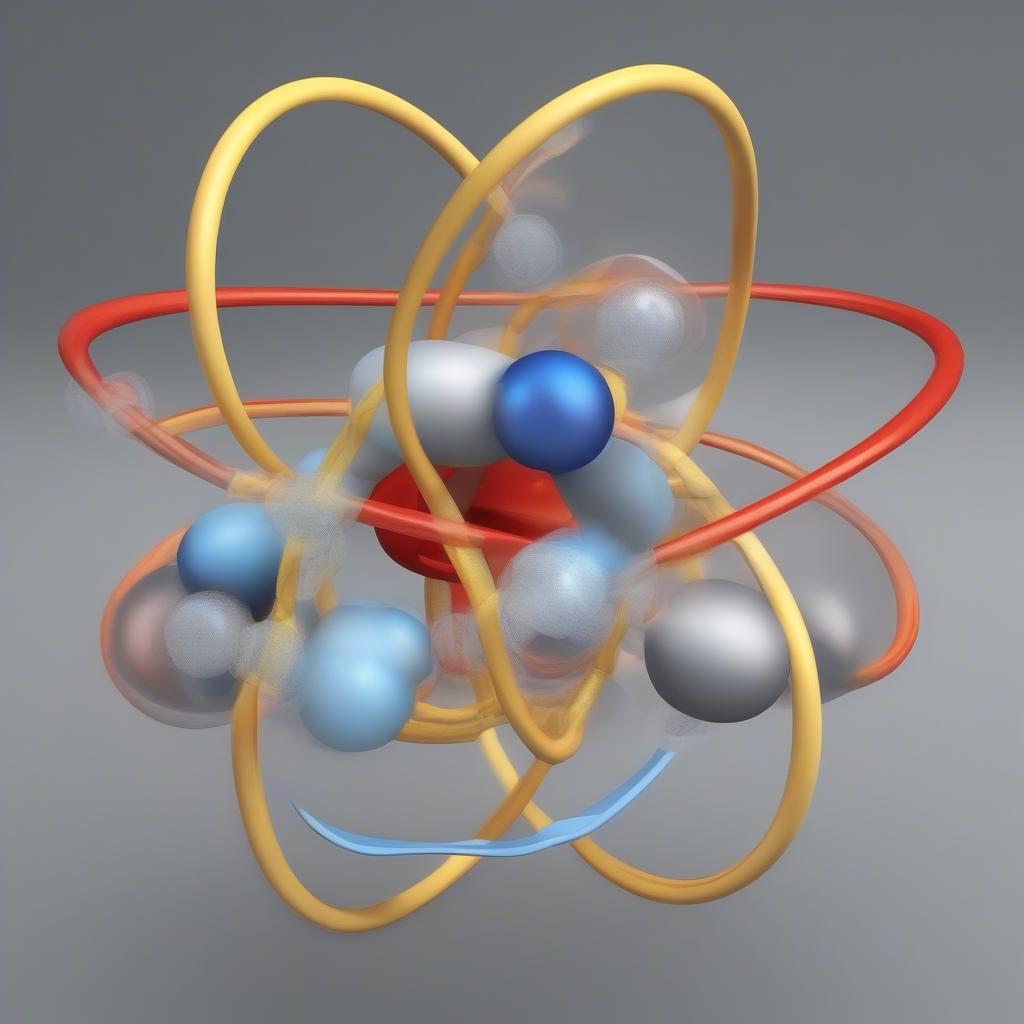 Mô hình cấu tạo nguyên tử
Mô hình cấu tạo nguyên tử
Bạn có thể tìm hiểu thêm về các bài tập chương 1 hóa 10 tại các bài tập chương 1 hóa 10.
Đồng Vị, Nguyên Tử Khối và Bài Tập Vận Dụng
Đồng vị là những nguyên tử cùng số proton (cùng nguyên tố) nhưng khác số neutron (khác số khối). Nguyên tử khối là khối lượng trung bình của các đồng vị của một nguyên tố, tính theo đơn vị u. Bài tập hóa học bài 1 lớp 10 thường yêu cầu tính toán nguyên tử khối dựa trên tỷ lệ phần trăm của các đồng vị.
Ví dụ: Nguyên tố Clo có hai đồng vị chính là 35Cl (chiếm 75,77%) và 37Cl (chiếm 24,23%). Nguyên tử khối trung bình của Clo được tính như sau:
Nguyên tử khối Cl = (35 x 75,77 + 37 x 24,23)/100 ≈ 35,5.
Bạn có thể tham khảo thêm giải hóa học bài 1 lớp 10 trang 126 để tìm hiểu chi tiết hơn về cách giải các bài tập liên quan đến đồng vị và nguyên tử khối.
Mẹo Học Tập Hiệu Quả cho Bài 1 Hóa 10
- Ghi chép cẩn thận: Ghi chép đầy đủ các khái niệm, công thức và ví dụ minh họa.
- Luyện tập thường xuyên: Giải nhiều bài tập để nắm vững kiến thức và rèn luyện kỹ năng tính toán.
- Học nhóm và thảo luận: Trao đổi với bạn bè để hiểu sâu hơn về bài học và giải đáp những thắc mắc.
 Mẹo học tập hiệu quả môn hóa học lớp 10
Mẹo học tập hiệu quả môn hóa học lớp 10
GS. TS. Nguyễn Văn A, chuyên gia hàng đầu về giáo dục Hóa học, chia sẻ: “Việc nắm vững kiến thức cơ bản về nguyên tử ở bài 1 lớp 10 là nền tảng quan trọng để học tốt Hóa học trong suốt những năm học tiếp theo.”
Kết luận
Bài tập hóa học bài 1 lớp 10 không chỉ giúp bạn hiểu rõ về cấu tạo nguyên tử, đồng vị và nguyên tử khối mà còn rèn luyện kỹ năng tính toán và tư duy logic. Hy vọng bài viết này đã cung cấp cho bạn những kiến thức hữu ích và giúp bạn tự tin chinh phục những thử thách đầu tiên của môn Hóa học lớp 10. Hãy luyện tập chăm chỉ và khám phá thế giới kỳ diệu của Hóa học!
FAQ
- Nguyên tử được cấu tạo bởi những hạt nào?
- Số khối của một nguyên tử là gì?
- Đồng vị là gì?
- Làm thế nào để tính nguyên tử khối trung bình của một nguyên tố?
- Tại sao việc học bài 1 lớp 10 lại quan trọng?
- Tôi có thể tìm tài liệu học tập Hóa 10 ở đâu?
- Làm thế nào để học tốt Hóa học 10?
Gợi ý các câu hỏi khác, bài viết khác có trong web
Bạn có thể tham khảo thêm đề thi học kì 1 hóa 10 trắc nghiệm violet và đề cương hóa 10 học kì 2 năm 2018 hoặc tìm hiểu giáo trình hóa lớp 10
Kêu gọi hành động:
Khi cần hỗ trợ hãy liên hệ Email: [email protected], địa chỉ: Mỹ Khê, Quận Hải Châu, Đà Nẵng, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.




