

Soạn Hóa Lớp 10 Bài 10 là một bước quan trọng giúp học sinh nắm vững kiến thức về cấu tạo vỏ điện tử của nguyên tử, một nền tảng cốt lõi cho việc học hóa học. Bài viết này sẽ hướng dẫn chi tiết cách soạn bài 10 hóa học lớp 10, cung cấp kiến thức trọng tâm và phương pháp học tập hiệu quả.
Mô Hình Nguyên Tử Và Các Lớp Điện Tử
Cấu tạo vỏ điện tử của nguyên tử được mô tả qua mô hình nguyên tử hiện đại. Nguyên tử gồm hạt nhân mang điện tích dương và các electron mang điện tích âm chuyển động xung quanh hạt nhân. Các electron này được sắp xếp thành từng lớp, gọi là lớp điện tử. Việc hiểu rõ cấu trúc này là chìa khóa để giải thích tính chất hóa học của các nguyên tố. 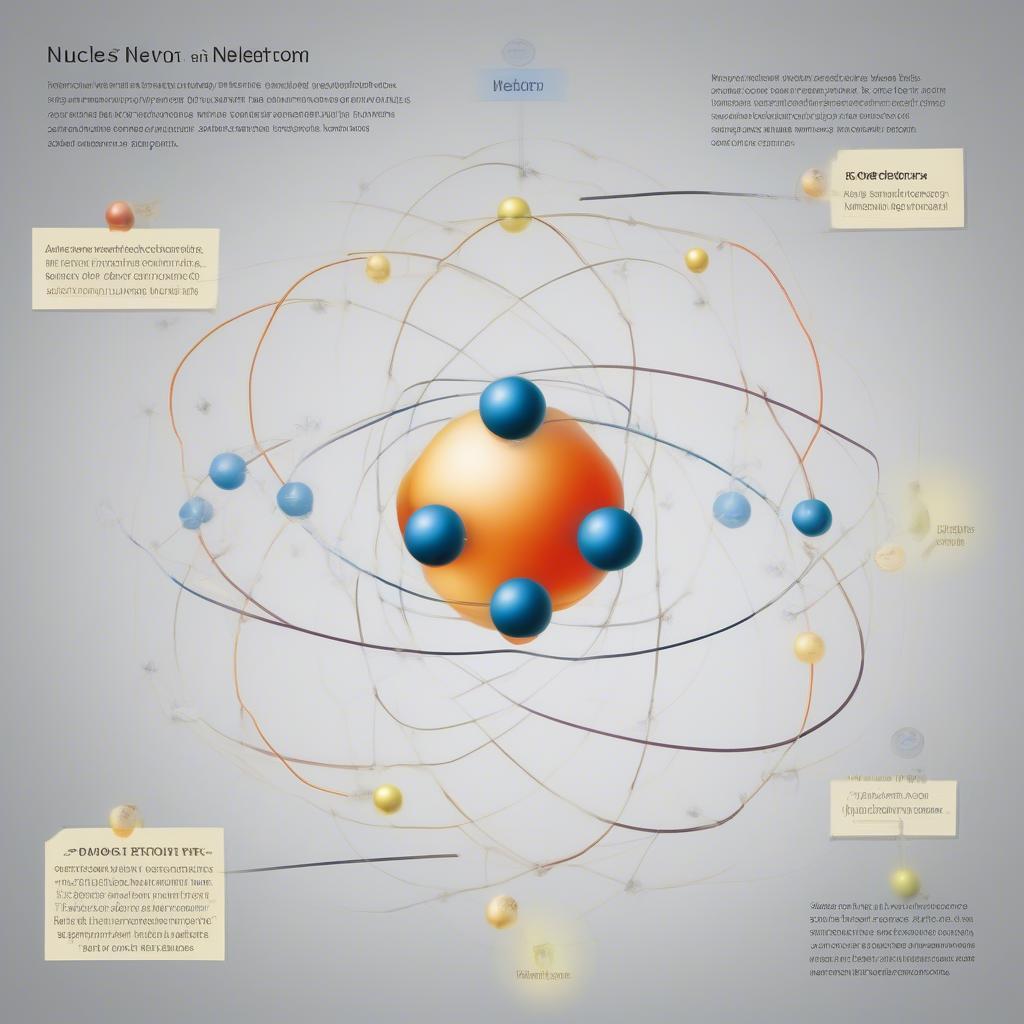 Cấu tạo nguyên tử
Cấu tạo nguyên tử
Lớp điện tử gần hạt nhân nhất được gọi là lớp K, tiếp theo là lớp L, M, N… Mỗi lớp điện tử chỉ chứa được một số lượng electron nhất định. Ví dụ, lớp K chứa tối đa 2 electron, lớp L chứa tối đa 8 electron. Số electron trên lớp ngoài cùng, gọi là electron hóa trị, quyết định tính chất hóa học của nguyên tố.
Nguyên Lý Pauli Và Quy Tắc Hund
Nguyên lý Pauli và quy tắc Hund là hai nguyên tắc quan trọng giúp xác định cách electron phân bố trong các lớp và phân lớp điện tử. Nguyên lý Pauli phát biểu rằng trong một nguyên tử, không thể có hai electron nào có cùng trạng thái lượng tử, tức là không thể có hai electron nào có cùng bốn số lượng tử.  Nguyên lý Pauli Điều này có nghĩa là mỗi orbital chỉ chứa tối đa hai electron với spin ngược chiều nhau.
Nguyên lý Pauli Điều này có nghĩa là mỗi orbital chỉ chứa tối đa hai electron với spin ngược chiều nhau.
Quy tắc Hund, hay còn gọi là quy tắc Hund về phân bố electron tối đa, quy định cách electron phân bố vào các orbital cùng phân lớp. Theo quy tắc này, các electron sẽ chiếm các orbital trống trước, sao cho số electron độc thân là tối đa và có spin cùng chiều.
Cấu Hình Electron Nguyên Tử
Cấu hình electron nguyên tử là cách biểu diễn sự phân bố electron trong các lớp và phân lớp của một nguyên tử. Cấu hình electron giúp chúng ta xác định số electron hóa trị, từ đó dự đoán tính chất hóa học của nguyên tố. Ví dụ, cấu hình electron của nguyên tử natri (Na) là 1s²2s²2p⁶3s¹. Điều này cho thấy natri có 1 electron hóa trị ở lớp ngoài cùng (lớp M).
soạn hóa lớp 10 bài 9 cung cấp kiến thức nền tảng về cấu tạo nguyên tử, giúp bạn hiểu rõ hơn về bài 10.
Ứng Dụng Của Cấu Tạo Vỏ Điện Tử Trong Dự Đoán Tính Chất Hóa Học
Cấu tạo vỏ điện tử của nguyên tử có vai trò quyết định trong việc dự đoán tính chất hóa học của nguyên tố. Số electron hóa trị quyết định khả năng tạo liên kết hóa học của nguyên tử. Ví dụ, các nguyên tố có 8 electron hóa trị (trừ He) thường rất bền vững về mặt hóa học, được gọi là khí hiếm.  Ứng dụng cấu tạo vỏ điện tử
Ứng dụng cấu tạo vỏ điện tử
soạn bài 29 30 hóa lớp 10 sẽ giúp bạn tìm hiểu sâu hơn về liên kết hóa học và các phản ứng hóa học.
Kết luận
Soạn hóa lớp 10 bài 10 về cấu tạo vỏ điện tử của nguyên tử là nền tảng quan trọng cho việc học hóa học. Hiểu rõ về cấu hình electron, nguyên lý Pauli, quy tắc Hund sẽ giúp bạn dự đoán tính chất hóa học của các nguyên tố. Hãy luyện tập thường xuyên và tìm hiểu thêm các tài liệu bổ trợ để nắm vững kiến thức này.
FAQ
- Nguyên lý Pauli là gì? Nguyên lý Pauli phát biểu rằng không thể có hai electron nào trong cùng một nguyên tử có cùng trạng thái lượng tử.
- Quy tắc Hund là gì? Quy tắc Hund quy định cách electron phân bố vào các orbital cùng phân lớp.
- Cấu hình electron là gì? Cấu hình electron là cách biểu diễn sự phân bố electron trong các lớp và phân lớp của một nguyên tử.
- Electron hóa trị là gì? Electron hóa trị là electron ở lớp ngoài cùng của nguyên tử.
- Tại sao cấu tạo vỏ điện tử quan trọng trong hóa học? Cấu tạo vỏ điện tử quyết định tính chất hóa học của nguyên tố.
- Làm sao để xác định số electron hóa trị? Số electron hóa trị được xác định từ cấu hình electron của nguyên tử.
- Tài liệu nào giúp học tốt bài 10 hóa 10? hóa 10 bài 38 violet có thể cung cấp thêm tài liệu tham khảo.
soạn hóa lớp 8 bài 10 cung cấp kiến thức cơ bản về nguyên tử, hỗ trợ cho việc học hóa 10.
Các tình huống thường gặp câu hỏi
Học sinh thường gặp khó khăn trong việc xác định cấu hình electron của các nguyên tử phức tạp và áp dụng nguyên lý Pauli, quy tắc Hund. typing master 10 việt hóa có thể không liên quan trực tiếp nhưng giúp cải thiện tốc độ gõ bàn phím, hỗ trợ học tập hiệu quả hơn.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về các bài học liên quan trên website Đại CHiến 2.




