

Cấu tạo nguyên tử là nền tảng của hóa học lớp 10. Hiểu rõ Chuyên đề Cấu Tạo Nguyên Tử Hóa 10 sẽ giúp bạn chinh phục môn Hóa một cách dễ dàng. Bài viết này sẽ cung cấp kiến thức chi tiết, chính xác về cấu tạo nguyên tử, từ hạt nhân đến lớp vỏ electron, cùng với những mẹo học tập hiệu quả.
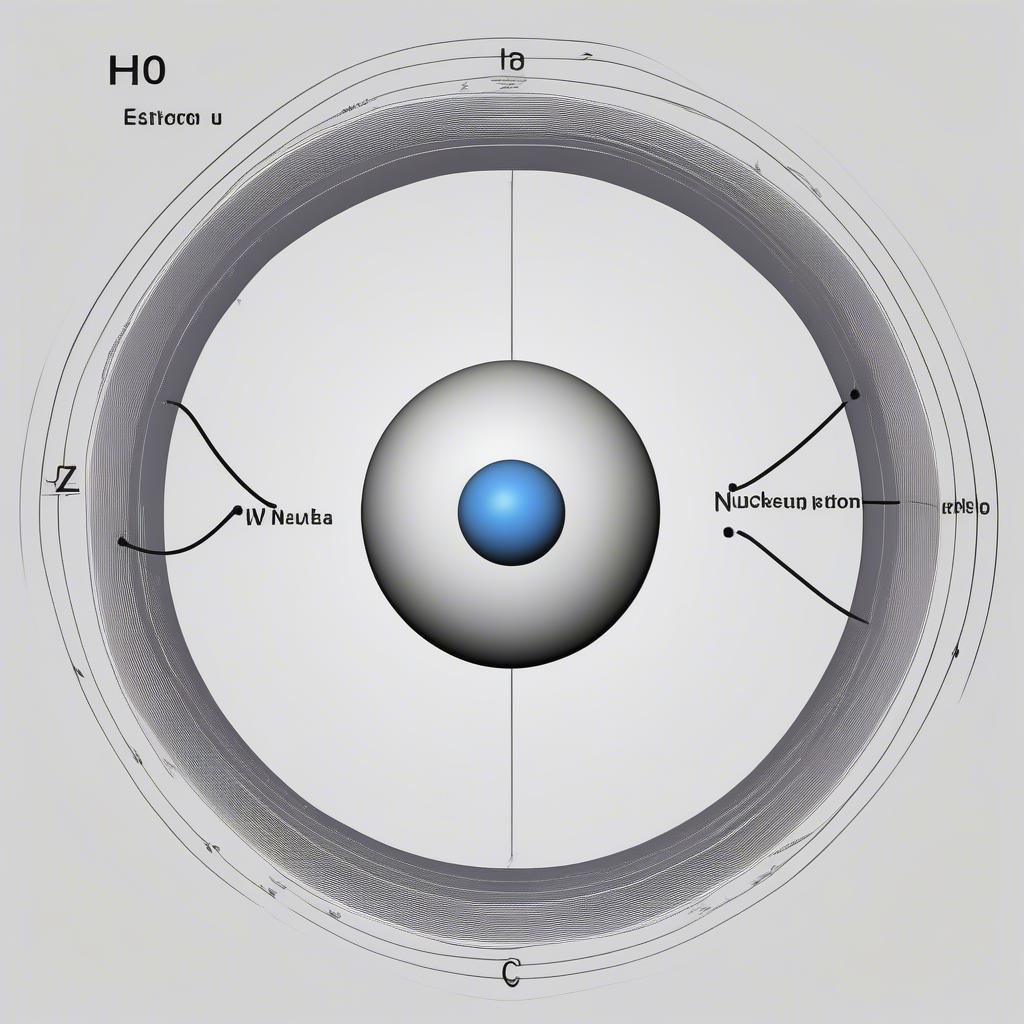 Cấu tạo nguyên tử Hidro
Cấu tạo nguyên tử Hidro
Khám Phá Hạt Nhân Nguyên Tử: Trung Tâm Vũ Trụ Bé Nhỏ
Hạt nhân nguyên tử là trung tâm chứa proton mang điện tích dương và neutron không mang điện. Số proton (ký hiệu Z) quyết định nguyên tố hóa học, còn tổng số proton và neutron (ký hiệu A) là số khối. Đồng vị là các nguyên tử cùng nguyên tố nhưng khác số neutron.
 Đồng vị Cacbon
Đồng vị Cacbon
Lớp Vỏ Electron: Vũ Điệu Của Các Electron
Electron mang điện tích âm chuyển động xung quanh hạt nhân theo các lớp và phân lớp electron. Sự sắp xếp electron tuân theo quy tắc Aufbau, nguyên lý Pauli và quy tắc Hund. Cấu hình electron biểu diễn sự phân bố electron trên các lớp và phân lớp.
Orbital Nguyên Tử: Ngôi Nhà Của Electron
Orbital nguyên tử là vùng không gian xung quanh hạt nhân mà xác suất tìm thấy electron là lớn nhất. Mỗi orbital chứa tối đa 2 electron. Các orbital có hình dạng và mức năng lượng khác nhau.
Mẹo Học Hiệu Quả Chuyên Đề Cấu Tạo Nguyên Tử
- Vẽ sơ đồ: Sử dụng sơ đồ để mô tả cấu tạo nguyên tử, lớp vỏ electron và các orbital.
- Luyện tập: Giải nhiều bài tập về cấu hình electron, đồng vị và số khối.
- Học nhóm: Trao đổi và thảo luận với bạn bè để hiểu sâu hơn về kiến thức.
“Hiểu rõ cấu tạo nguyên tử là chìa khóa để mở ra cánh cửa vào thế giới hóa học,” – PGS. TS. Nguyễn Văn A, chuyên gia hóa học hàng đầu Việt Nam.
Làm sao để nhớ được cấu hình electron?
Sử dụng quy tắc Aufbau, nguyên lý Pauli và quy tắc Hund kết hợp với việc luyện tập thường xuyên.
 Cấu hình electron Clo
Cấu hình electron Clo
Kết luận
Chuyên đề cấu tạo nguyên tử hóa 10 là kiến thức nền tảng quan trọng. Nắm vững kiến thức này sẽ giúp bạn học tốt hóa học và đạt kết quả cao trong các kỳ thi. Hãy kiên trì luyện tập và khám phá thế giới vi mô đầy thú vị của nguyên tử!
đề thi chuyên hóa vào lớp 10 trường amsterdam 2016
FAQ
- Proton và neutron khác nhau như thế nào?
- Số khối có ý nghĩa gì?
- Cấu hình electron là gì?
- Làm thế nào để xác định số electron lớp ngoài cùng?
- Tại sao cần phải học về cấu tạo nguyên tử?
- Quy tắc Aufbau là gì?
- Nguyên lý Pauli nói gì?
Mô tả các tình huống thường gặp câu hỏi
Học sinh thường gặp khó khăn trong việc xác định cấu hình electron của các nguyên tố, đặc biệt là các nguyên tố chuyển tiếp. Việc phân biệt giữa số khối và nguyên tử khối cũng là một vấn đề thường gặp.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về bảng tuần hoàn các nguyên tố hóa học và liên kết hóa học. Xem thêm trắc nghiệm hóa 10 thi học kì 2.




