

Nguyên tử, đơn vị cơ bản của vật chất, là trọng tâm của Hóa 10 Chương 1. Chương này cung cấp nền tảng vững chắc cho việc học hóa học ở bậc THPT, giúp học sinh hiểu rõ về cấu trúc nguyên tử, bảng tuần hoàn và liên kết hóa học. Việc nắm vững kiến thức hóa 10 chương 1 là chìa khóa để thành công trong các chương học tiếp theo.
Cấu Tạo Nguyên Tử: Hạt Nhân và Lớp Vỏ Điện Tử
Cấu tạo nguyên tử bao gồm hạt nhân mang điện tích dương và lớp vỏ electron mang điện tích âm. Hạt nhân chứa proton và neutron, trong khi electron quay quanh hạt nhân theo các quỹ đạo xác định. Số proton (ký hiệu là Z) quyết định nguyên tố hóa học, còn tổng số proton và neutron (ký hiệu là A) được gọi là số khối. 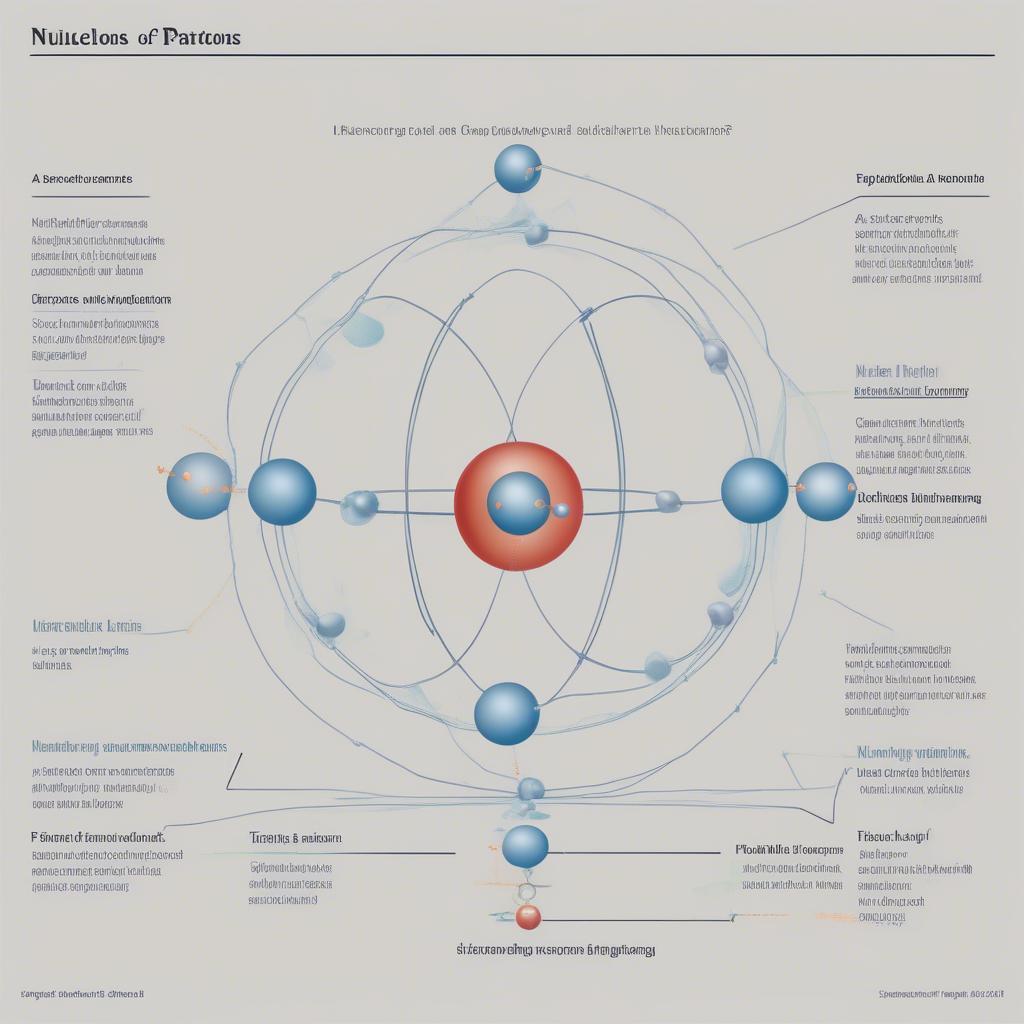 Cấu tạo nguyên tử
Cấu tạo nguyên tử
Hiểu rõ cấu tạo nguyên tử giúp ta giải thích được nhiều hiện tượng hóa học. Ví dụ, số electron lớp ngoài cùng quyết định tính chất hóa học của nguyên tố. Các nguyên tố có cùng số electron lớp ngoài cùng thường có tính chất hóa học tương tự nhau.
Khối Lượng Nguyên Tử và Mol
Khối lượng của một nguyên tử cực kỳ nhỏ, do đó, người ta sử dụng đơn vị khối lượng nguyên tử (u) để biểu thị. Một mol nguyên tử chứa số Avogadro (6,022 x 10^23) nguyên tử. Khối lượng mol của một nguyên tố bằng khối lượng nguyên tử của nó tính theo gam.  Khối lượng nguyên tử và mol
Khối lượng nguyên tử và mol
Việc tính toán số mol và khối lượng là kỹ năng quan trọng trong hóa học, giúp chúng ta chuyển đổi giữa số lượng hạt, khối lượng và thể tích chất.
Bảng Tuần Hoàn Các Nguyên Tố Hóa Học
Bảng tuần hoàn là một công cụ hữu ích để sắp xếp và phân loại các nguyên tố hóa học. Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân và được chia thành các chu kỳ và nhóm. Các nguyên tố trong cùng một nhóm có tính chất hóa học tương tự nhau. giải bài tập hóa 10 bài 4 trang 19
Sự Biến Đổi Tuần Hoàn Tính Chất Của Nguyên Tố
Tính chất của các nguyên tố trong bảng tuần hoàn biến đổi tuần hoàn theo điện tích hạt nhân. Ví dụ, bán kính nguyên tử giảm dần từ trái sang phải trong một chu kỳ và tăng dần từ trên xuống dưới trong một nhóm.
- Độ âm điện: Xu hướng của một nguyên tử hút electron về phía mình khi tham gia liên kết hóa học.
- Năng lượng ion hóa: Năng lượng cần thiết để loại bỏ một electron khỏi một nguyên tử.
Chuyên gia Nguyễn Thị Lan Anh, giảng viên Hóa học tại Đại học Khoa học Tự nhiên, chia sẻ: “Việc nắm vững bảng tuần hoàn là nền tảng để học tốt hóa học. Bảng tuần hoàn không chỉ giúp học sinh ghi nhớ tính chất của các nguyên tố mà còn dự đoán được tính chất của các nguyên tố chưa được khám phá.”
Đồng Vị
Đồng vị là các nguyên tử của cùng một nguyên tố nhưng có số neutron khác nhau. Ví dụ, hydro có ba đồng vị: protium, deuterium và tritium.  Đồng vị
Đồng vị
TS. Phạm Văn Hùng, nhà nghiên cứu tại Viện Hóa học, cho biết: “Đồng vị có nhiều ứng dụng quan trọng trong khoa học và đời sống, từ xác định niên đại cổ vật đến điều trị ung thư.”
Kết luận
Hóa 10 chương 1 cung cấp kiến thức nền tảng về cấu tạo nguyên tử, bảng tuần hoàn và đồng vị. Nắm vững kiến thức này là bước đầu tiên để chinh phục môn Hóa học ở bậc THPT. bài 5 sgk trang 74 hóa 10 giải hóa 10 bài 19
FAQ
- Proton và neutron khác nhau như thế nào?
- Số khối của một nguyên tử là gì?
- Bảng tuần hoàn được sắp xếp như thế nào?
- Đồng vị là gì?
- Tại sao việc học hóa 10 chương 1 quan trọng?
- Làm thế nào để học tốt hóa 10 chương 1?
- Ứng dụng của đồng vị trong đời sống là gì?
Gợi ý các câu hỏi, bài viết khác:
Bạn có thể tìm hiểu thêm về các bài tập và kiến thức liên quan đến Hóa 10 tại Đại CHiến 2.
Kêu gọi hành động:
Khi cần hỗ trợ hãy liên hệ Email: Contact@daichien2.com, địa chỉ: Mỹ Khê, Quận Hải Châu, Đà Nẵng, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.

