

NaCl, hay còn gọi là muối ăn, là một hợp chất hóa học quen thuộc trong cuộc sống hàng ngày. Trong chương trình Hóa học lớp 10, NaCl là một trong những chất được nghiên cứu kỹ lưỡng về cấu tạo, tính chất và ứng dụng. Bài viết này sẽ cung cấp cho bạn cái nhìn chi tiết về NaCl trong hóa 10, từ thành phần cấu tạo đến các tính chất vật lý, hóa học quan trọng.
Cấu tạo và Thành phần của NaCl (hóa 10 nacl)
NaCl được tạo thành từ liên kết ion giữa cation Na+ và anion Cl-. Liên kết này hình thành do sự chênh lệch điện tích giữa hai ion. Na+ mang điện tích dương và Cl- mang điện tích âm, tạo nên lực hút tĩnh điện mạnh mẽ. Cấu trúc tinh thể của NaCl là mạng tinh thể lập phương, mỗi ion Na+ được bao quanh bởi 6 ion Cl- và ngược lại. Sự sắp xếp này tạo nên tính chất đặc trưng của NaCl.
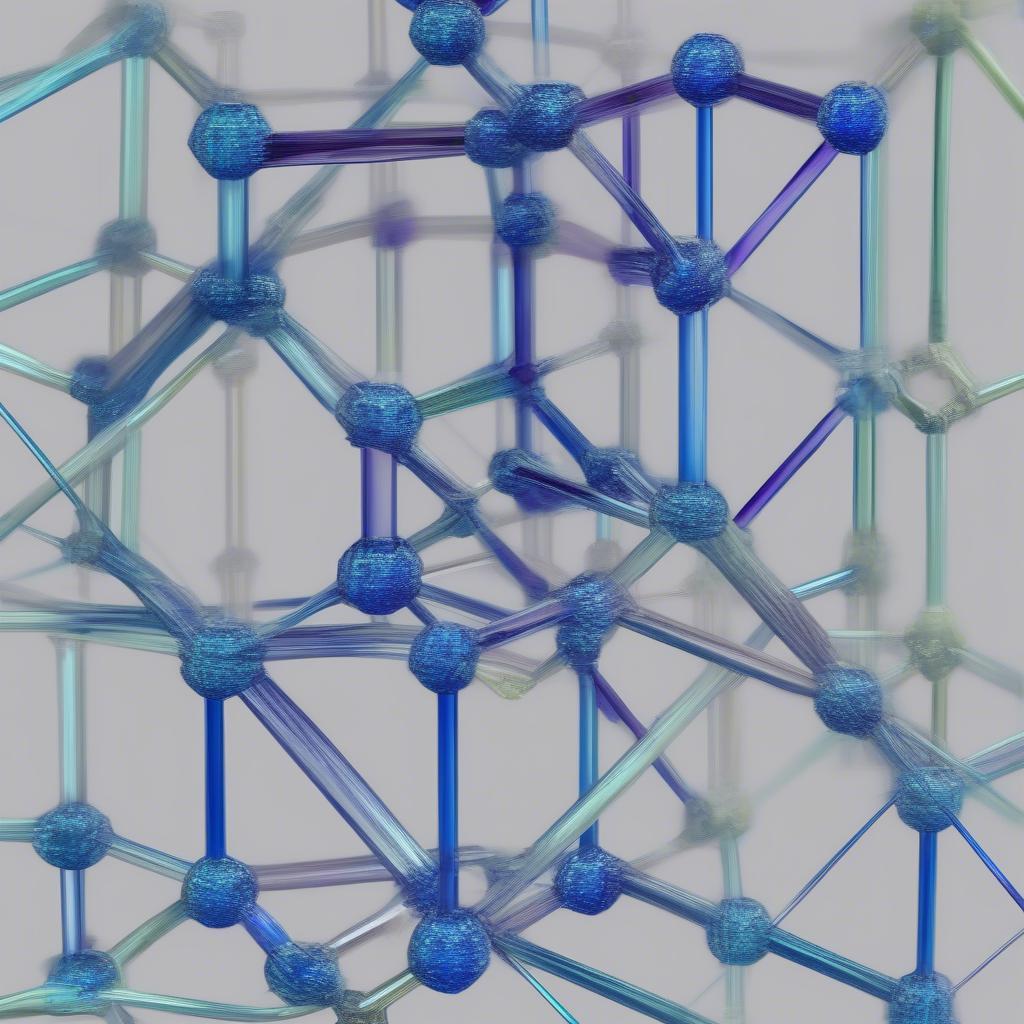 Cấu tạo tinh thể NaCl
Cấu tạo tinh thể NaCl
Tính Chất Vật Lý của NaCl
NaCl là chất rắn kết tinh, màu trắng, có vị mặn đặc trưng. Nó dễ dàng hòa tan trong nước và một số dung môi khác. Điểm nóng chảy và điểm sôi của NaCl tương đối cao, lần lượt là 801°C và 1413°C, cho thấy liên kết ion trong NaCl rất bền vững.
Tính Chất Hóa Học của NaCl (thanh cl)
NaCl thể hiện tính chất hóa học của một muối điển hình. Nó có thể tham gia vào các phản ứng hóa học như:
- Phản ứng với AgNO3: Tạo kết tủa trắng AgCl, một phản ứng đặc trưng để nhận biết ion Cl-.
- Điện phân nóng chảy: Sản phẩm thu được là natri kim loại và khí clo.
- Điều chế HCl: NaCl tác dụng với H2SO4 đặc nóng tạo ra khí HCl.
 Phản ứng hóa học của NaCl
Phản ứng hóa học của NaCl
Ứng dụng của NaCl trong Đời sống
NaCl có vai trò quan trọng trong đời sống và sản xuất:
- Gia vị: Dùng trong nấu ăn hàng ngày.
- Bảo quản thực phẩm: Ngăn chặn sự phát triển của vi khuẩn.
- Sản xuất hóa chất: Nguyên liệu để điều chế NaOH, Cl2, HCl, nước Javen…
- Y tế: Dùng trong dịch truyền, pha chế thuốc.
NaCl và Vai trò trong Hóa học 10
Việc nghiên cứu NaCl trong chương trình Hóa học lớp 10 giúp học sinh:
- Nắm vững kiến thức về liên kết ion và cấu trúc tinh thể.
- Hiểu rõ tính chất vật lý và hóa học của muối.
- Vận dụng kiến thức vào giải thích các hiện tượng trong thực tế.
 Ứng dụng NaCl trong đời sống
Ứng dụng NaCl trong đời sống
Kết luận
NaCl (hóa 10 nacl thanh cl) là một hợp chất quan trọng, không chỉ trong đời sống hàng ngày mà còn trong chương trình Hóa học lớp 10. Hiểu rõ về NaCl giúp học sinh nắm vững kiến thức cơ bản về liên kết ion, tính chất của muối và ứng dụng của nó.
FAQ
- NaCl có tan trong nước không? (Có)
- Công thức hóa học của muối ăn là gì? (NaCl)
- NaCl có màu gì? (Trắng)
- NaCl có dẫn điện không? (Dẫn điện khi nóng chảy hoặc hòa tan trong nước)
- NaCl được tạo thành từ những nguyên tố nào? (Natri và Clo)
- Điểm nóng chảy của NaCl là bao nhiêu? (801°C)
- NaCl có ứng dụng gì trong y tế? (Dùng trong dịch truyền, pha chế thuốc)
Mô tả các tình huống thường gặp câu hỏi
Học sinh thường thắc mắc về phản ứng của NaCl với AgNO3, tại sao tạo kết tủa trắng. Hoặc câu hỏi về việc tại sao NaCl dẫn điện khi nóng chảy hoặc hòa tan trong nước.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về các loại muối khác, phản ứng trao đổi ion, hoặc cách điều chế các chất từ NaCl.




