

Hóa Học 10 Bài 3 mở ra cánh cửa vào thế giới vi mô của nguyên tử, một chủ đề nền tảng cho toàn bộ chương trình Hóa học lớp 10. Bài viết này sẽ cung cấp cho bạn kiến thức chi tiết, chính xác về cấu tạo nguyên tử, từ các hạt cơ bản đến mô hình nguyên tử hiện đại.
Tìm Hiểu Về Cấu Tạo Nguyên Tử: Hạt Nhân và Lớp Vỏ Electron
Nguyên tử, đơn vị cơ bản của vật chất, được cấu tạo từ hạt nhân mang điện tích dương và lớp vỏ electron mang điện tích âm. Hạt nhân chứa proton (mang điện tích dương) và neutron (không mang điện). Lớp vỏ electron bao gồm các electron chuyển động xung quanh hạt nhân. bài giảng hóa học 10 bài 38 sẽ giúp bạn hiểu rõ hơn về các khái niệm này.
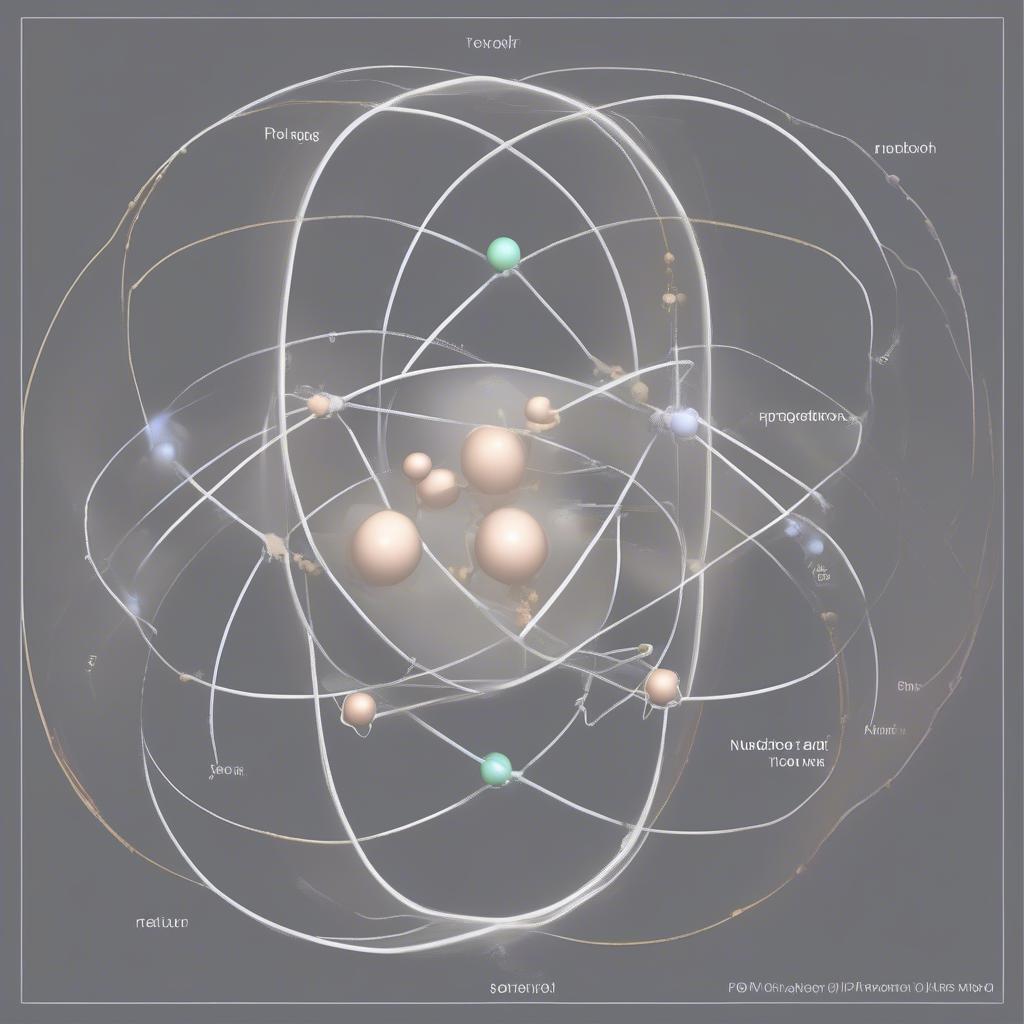 Cấu tạo nguyên tử
Cấu tạo nguyên tử
Hạt Nhân Nguyên Tử: Trung Tâm Của Nguyên Tử
Hạt nhân, chiếm phần lớn khối lượng của nguyên tử, được tạo thành từ proton và neutron. Số proton, hay số hiệu nguyên tử (Z), xác định nguyên tố hóa học. Tổng số proton và neutron là số khối (A). Hiểu rõ về hạt nhân là chìa khóa để nắm vững hóa học 10 bài 3.
Nguyên tử trung hòa điện khi số proton bằng số electron. Nếu số electron khác số proton, ta có ion. Ion dương (cation) có số electron ít hơn số proton, còn ion âm (anion) có số electron nhiều hơn số proton.
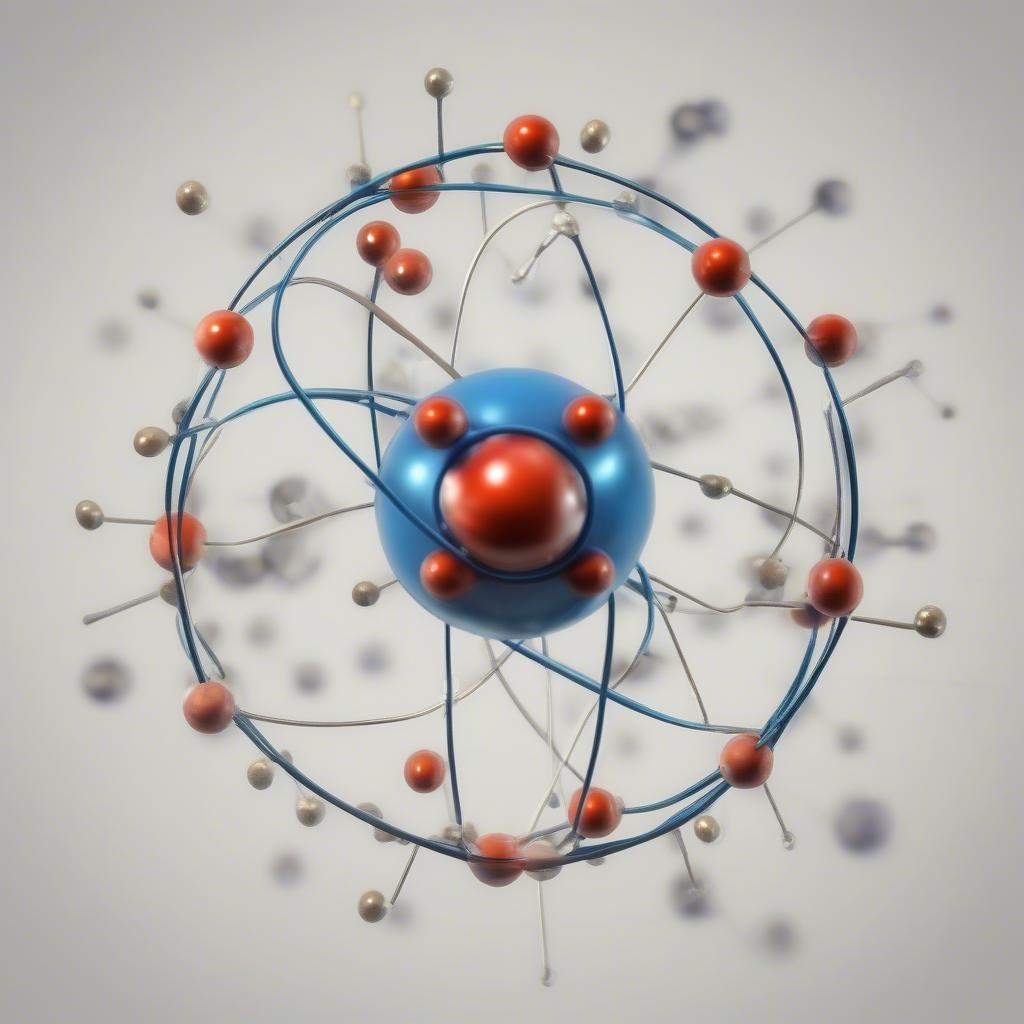 Hạt nhân nguyên tử
Hạt nhân nguyên tử
Lớp Vỏ Electron và Sự Sắp Xếp Electron
Electron chuyển động xung quanh hạt nhân trong các lớp và phân lớp electron. Sự sắp xếp electron tuân theo các quy tắc và nguyên lý nhất định. Việc nắm vững cấu hình electron sẽ giúp bạn dự đoán tính chất hóa học của nguyên tố. giải bài tập hóa học 10 bài 34 cung cấp các bài tập vận dụng về cấu hình electron.
Mô Hình Nguyên Tử Hiện Đại: Mô Hình Orbital Nguyên Tử
Mô hình nguyên tử hiện đại, hay mô hình orbital nguyên tử, mô tả electron không chuyển động theo quỹ đạo xác định mà tồn tại trong các orbital. Orbital là vùng không gian xung quanh hạt nhân có xác suất tìm thấy electron cao nhất. Hóa học 10 bài 3 giới thiệu về các loại orbital và cách chúng được sắp xếp trong nguyên tử.
Orbital Nguyên Tử và Số Lượng Tử
Mỗi orbital được đặc trưng bởi bộ bốn số lượng tử. Số lượng tử chính (n) xác định mức năng lượng của electron. Số lượng tử phụ (l) xác định hình dạng của orbital. Số lượng tử từ (ml) xác định sự định hướng của orbital trong không gian. Số lượng tử spin (ms) xác định chiều quay của electron.
GS. TS. Nguyễn Văn A, chuyên gia Hóa học hàng đầu cho biết: “Việc hiểu rõ về orbital và số lượng tử là bước đệm quan trọng để nắm vững các kiến thức hóa học nâng cao.”
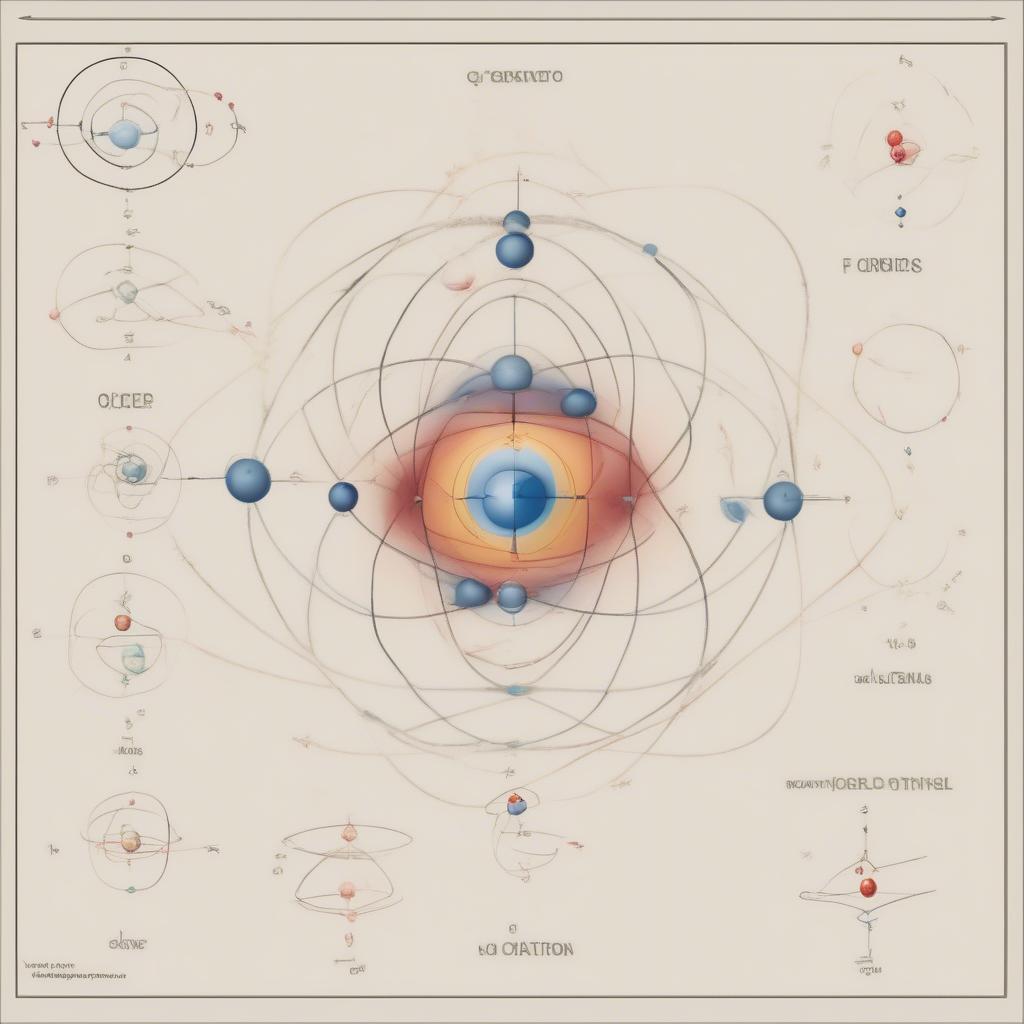 Mô hình Orbital Nguyên Tử
Mô hình Orbital Nguyên Tử
Kết Luận: Nắm Vững Kiến Thức Hóa Học 10 Bài 3
Hóa học 10 bài 3 về cấu tạo nguyên tử là nền tảng quan trọng cho việc học Hóa học. Hiểu rõ về cấu tạo nguyên tử sẽ giúp bạn tiếp cận các bài học tiếp theo một cách dễ dàng hơn. hóa học 10 bài32 và bài tập hóa học 10 bài 32 cũng là những tài liệu hữu ích cho bạn.
FAQ về Hóa Học 10 Bài 3
- Proton và neutron khác nhau như thế nào?
- Số hiệu nguyên tử và số khối là gì?
- Cấu hình electron là gì?
- Orbital nguyên tử là gì?
- Các loại orbital và số lượng tử là gì?
- Tại sao cần phải học về cấu tạo nguyên tử?
- hóa học 10 bài 35 có liên quan gì đến bài 3?
Khi cần hỗ trợ hãy liên hệ Email: [email protected], địa chỉ: Mỹ Khê, Quận Hải Châu, Đà Nẵng, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.




