

Kiến Thức Cơ Bản Của Hóa 10 là nền tảng quan trọng cho việc học tập môn Hóa học ở các lớp tiếp theo. Việc nắm chắc những kiến thức này sẽ giúp bạn dễ dàng tiếp cận và chinh phục những kiến thức nâng cao hơn. Bài viết này sẽ cung cấp cho bạn một cái nhìn tổng quan về kiến thức cơ bản của hóa 10, giúp bạn xây dựng một nền tảng vững chắc.
Chương 1: Nguyên Tử
Chương này xoay quanh cấu tạo nguyên tử, bảng tuần hoàn và các loại liên kết hóa học. Hiểu rõ cấu tạo nguyên tử sẽ giúp bạn dự đoán tính chất của các nguyên tố và hợp chất.
- Cấu tạo nguyên tử: Nguyên tử gồm hạt nhân mang điện tích dương (proton và neutron) và các electron mang điện tích âm chuyển động xung quanh hạt nhân. Số hiệu nguyên tử (Z) bằng số proton, cũng chính là số electron trong nguyên tử trung hòa.
- Bảng tuần hoàn: Bảng tuần hoàn sắp xếp các nguyên tố theo chiều tăng dần của số hiệu nguyên tử. Vị trí của nguyên tố trong bảng tuần hoàn phản ánh cấu hình electron và do đó, dự đoán được tính chất hóa học của nguyên tố.
- Liên kết hóa học: Các nguyên tử liên kết với nhau để tạo thành phân tử hoặc tinh thể. Có ba loại liên kết chính: liên kết ion, liên kết cộng hóa trị và liên kết kim loại.
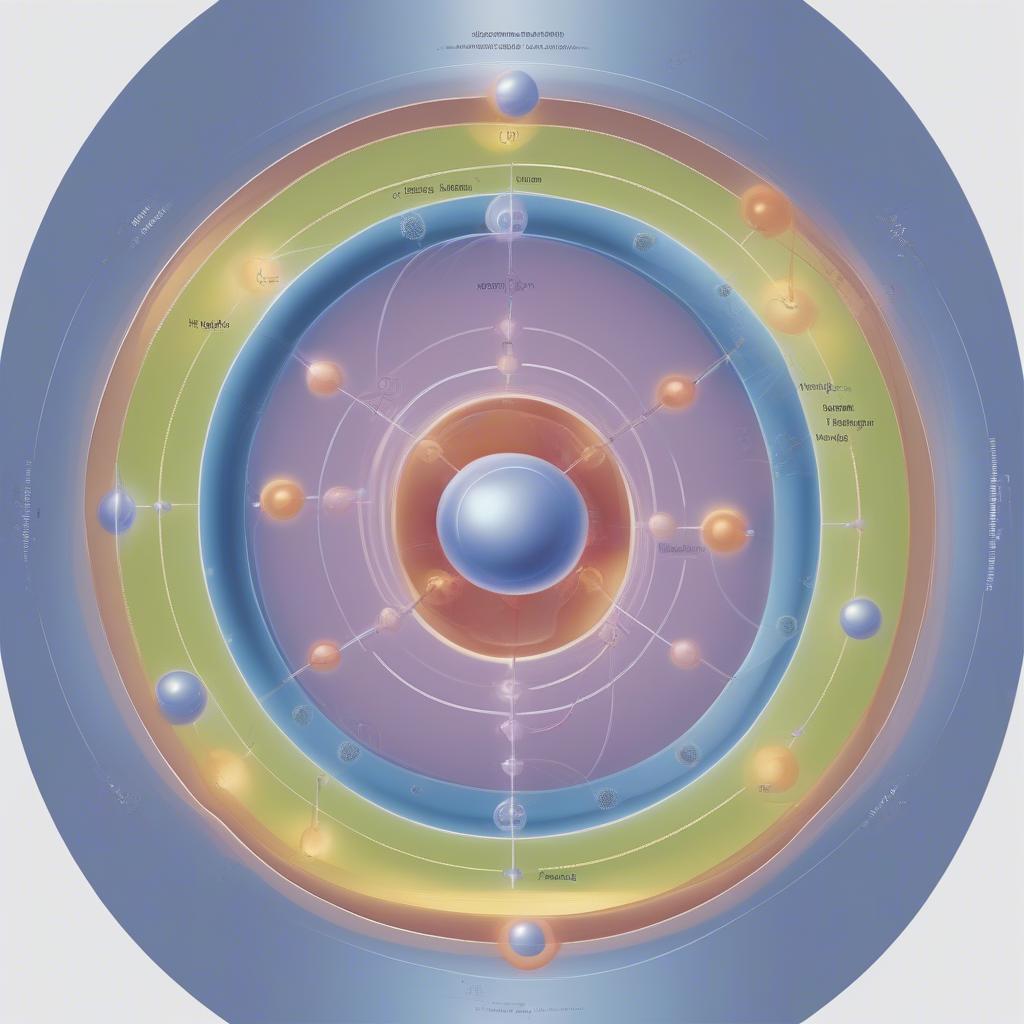 Cấu Tạo Nguyên Tử
Cấu Tạo Nguyên Tử
Bạn có muốn biết thêm về cấu tạo chi tiết của nguyên tử và cách tính khối lượng nguyên tử? Hãy tham khảo bài tập 6 trang 16 hóa 10.
Chương 2: Phân Tử
Chương này tập trung vào các loại phản ứng hóa học, cách viết và cân bằng phương trình hóa học.
- Phản ứng hóa học: Là quá trình biến đổi chất này thành chất khác. Có nhiều loại phản ứng hóa học khác nhau như phản ứng hóa hợp, phản ứng phân hủy, phản ứng thế, phản ứng trao đổi.
- Phương trình hóa học: Diễn tả phản ứng hóa học bằng các công thức hóa học. Việc cân bằng phương trình hóa học đảm bảo nguyên tắc bảo toàn khối lượng.
- Mol: Đơn vị đo lường lượng chất. Một mol chất chứa 6,022 x 10^23 hạt (nguyên tử, phân tử, ion).
 Phản Ứng Hóa Học
Phản Ứng Hóa Học
Để luyện tập thêm về các dạng bài tập liên quan đến mol và phương trình hóa học, bạn có thể xem bài 12 hóa 10.
Chương 3: Dung Dịch
Chương này đề cập đến các khái niệm về dung dịch, nồng độ dung dịch, và các tính toán liên quan.
- Dung dịch: Là hỗn hợp đồng nhất của chất tan và dung môi.
- Nồng độ: Biểu thị lượng chất tan có trong một lượng dung dịch nhất định. Có nhiều cách biểu diễn nồng độ như nồng độ phần trăm, nồng độ mol/lít.
- Pha chế dung dịch: Quy trình pha chế dung dịch đúng nồng độ đòi hỏi sự chính xác và cẩn thận.
Giáo sư Nguyễn Văn A, chuyên gia Hóa học tại Đại học Khoa học Tự nhiên, nhấn mạnh: “Nắm vững kiến thức về dung dịch là điều kiện tiên quyết để học tốt Hóa học ở các cấp học cao hơn.”
Bạn đang tìm kiếm các công thức quan trọng trong chương 1? Hãy xem ngay công thức hóa 10 chương 1.
 Pha Chế Dung Dịch
Pha Chế Dung Dịch
Tiến sĩ Trần Thị B, giảng viên Hóa học tại trường THPT Chuyên Lê Hồng Phong, chia sẻ: “Việc làm bài tập trắc nghiệm sẽ giúp học sinh ôn tập và củng cố kiến thức một cách hiệu quả.” Bạn có thể luyện tập với bài tập trắc nghiem chuong 1 hóa 10.
Kết Luận
Kiến thức cơ bản của hóa 10 là nền tảng quan trọng cho việc học tập Hóa học. Hy vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích và giúp bạn tự tin hơn trong việc học tập môn Hóa. Hãy tiếp tục khám phá và chinh phục những kiến thức mới! Để nắm vững kiến thức cơ bản, hãy tham khảo chuẩn kiến thức kĩ năng hóa học 10 cơ bản.
FAQ
- Hóa học 10 có khó không?
- Làm thế nào để học tốt Hóa 10?
- Tài liệu nào hỗ trợ học tập Hóa 10 hiệu quả?
- Làm sao để nhớ được bảng tuần hoàn?
- Ý nghĩa của việc cân bằng phương trình hóa học là gì?
- Cách tính nồng độ dung dịch như thế nào?
- Tại sao cần học kiến thức cơ bản của Hóa 10?
Khi cần hỗ trợ hãy liên hệ Email: [email protected], địa chỉ: Mỹ Khê, Quận Hải Châu, Đà Nẵng, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.




