

Orbitan là một khái niệm quan trọng trong chương trình Hóa học lớp 10, giúp chúng ta hiểu rõ hơn về cấu trúc nguyên tử và tính chất của các nguyên tố. Vậy obitan là gì và nó có ý nghĩa như thế nào trong việc hình thành liên kết hóa học? Hãy cùng Đại CHiến 2 tìm hiểu chi tiết trong bài viết này.
Orbitan là gì? Định nghĩa obitan trong Hóa học 10
Orbitan, hay orbital nguyên tử, là một vùng không gian xung quanh hạt nhân nguyên tử, nơi mà xác suất tìm thấy electron là cao nhất (thường là 90%). Khác với mô hình nguyên tử Bohr, nơi electron chuyển động theo quỹ đạo xác định, mô hình nguyên tử hiện đại sử dụng khái niệm obitan để mô tả vùng không gian mà electron có thể tồn tại. Tưởng tượng obitan như một đám mây electron bao quanh hạt nhân, với mật độ đám mây thể hiện xác suất tìm thấy electron.
 Vùng không gian xác suất tìm thấy electron
Vùng không gian xác suất tìm thấy electron
Các loại obitan và hình dạng của chúng
Trong chương trình Hóa 10, chúng ta tìm hiểu về các loại obitan s, p, d và f. Mỗi loại obitan có hình dạng và mức năng lượng khác nhau. Orbitan s có hình cầu, obitan p có hình số 8 không gian, còn obitan d và f có hình dạng phức tạp hơn. Sự khác biệt về hình dạng và năng lượng của các obitan ảnh hưởng đến cách các nguyên tử liên kết với nhau để tạo thành phân tử.
Orbitan s: Hình cầu đối xứng
Orbitan s có hình cầu đối xứng xung quanh hạt nhân. Đây là loại obitan đơn giản nhất và có mức năng lượng thấp nhất trong mỗi lớp electron.
Orbitan p: Hình số 8 không gian
Orbitan p có hình số 8 không gian, chia thành ba obitan px, py, và pz, nằm dọc theo ba trục tọa độ x, y và z. Mỗi obitan p chứa tối đa 2 electron.
 Các loại obitan s, p, d, f
Các loại obitan s, p, d, f
Orbitan d và f: Hình dạng phức tạp
Orbitan d và f có hình dạng phức tạp hơn so với obitan s và p. Chúng xuất hiện ở các lớp electron có mức năng lượng cao hơn và đóng vai trò quan trọng trong tính chất của các nguyên tố chuyển tiếp.
Ý nghĩa của obitan trong việc hình thành liên kết hóa học
Orbitan đóng vai trò quan trọng trong việc hình thành liên kết hóa học. Khi các nguyên tử kết hợp với nhau, các obitan nguyên tử của chúng có thể xen phủ để tạo thành obitan phân tử. Các electron trong obitan phân tử được chia sẻ giữa các nguyên tử, tạo nên liên kết hóa học. Kiến thức về obitan giúp chúng ta dự đoán được loại liên kết và hình dạng của phân tử.
Sự khác nhau giữa obitan và quỹ đạo
Nhiều bạn học sinh thường nhầm lẫn giữa obitan và quỹ đạo. Quỹ đạo là một khái niệm trong mô hình nguyên tử Bohr, mô tả đường đi xác định của electron xung quanh hạt nhân. Trong khi đó, obitan là một khái niệm trong mô hình nguyên tử hiện đại, mô tả vùng không gian xác suất tìm thấy electron. Orbitan không phải là một đường đi cố định mà là một vùng không gian ba chiều.
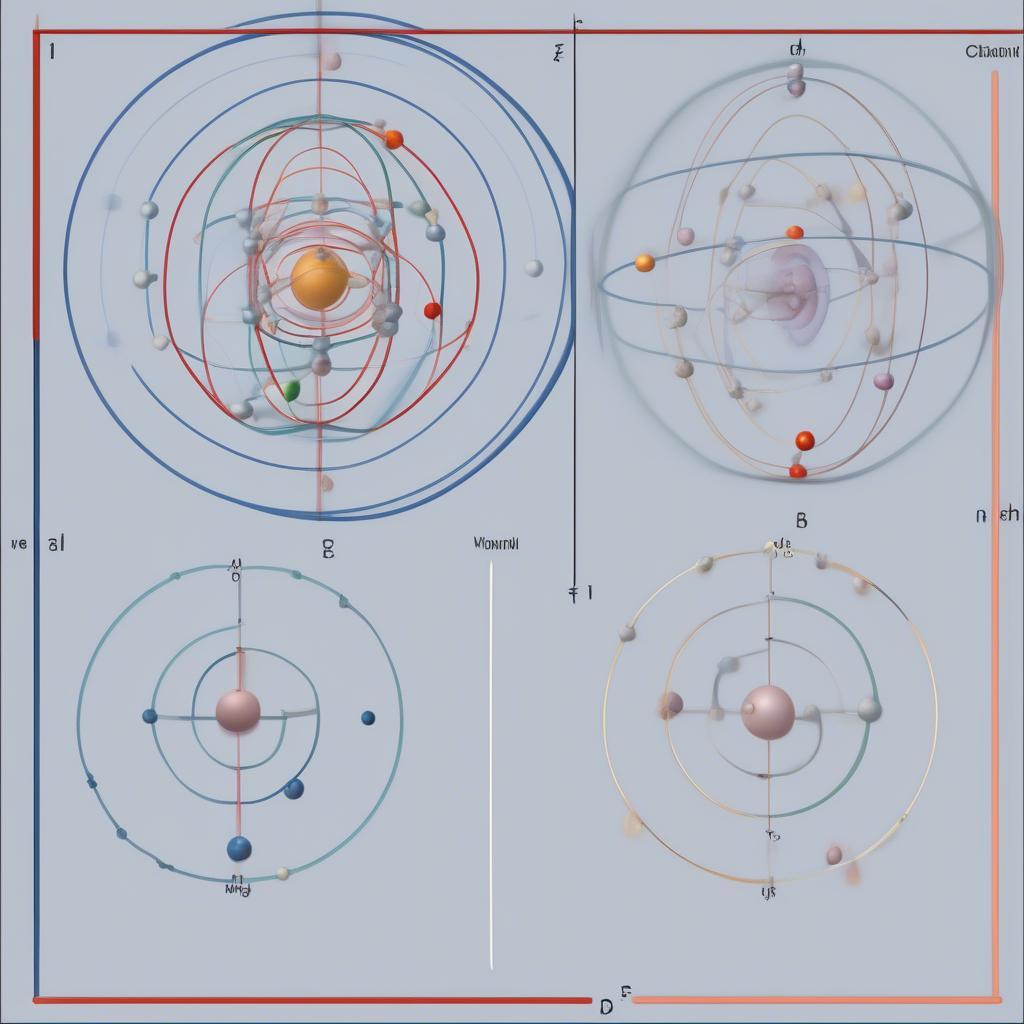 Sự khác nhau giữa obitan và quỹ đạo
Sự khác nhau giữa obitan và quỹ đạo
Kết luận: Orbitan – Chìa khóa hiểu về cấu trúc nguyên tử
Hiểu rõ về obitan là chìa khóa để nắm vững kiến thức về cấu trúc nguyên tử và liên kết hóa học trong chương trình Hóa 10. Bài viết này đã cung cấp những thông tin cơ bản về obitan, các loại obitan và ý nghĩa của chúng. Hy vọng bài viết đã giúp bạn hiểu rõ hơn về khái niệm “Obitan Là Gì Hóa 10”.
FAQ về Orbitan trong Hóa 10
-
Orbitan là gì?
Orbitan là vùng không gian xung quanh hạt nhân nguyên tử, nơi có xác suất cao nhất tìm thấy electron.
-
Có mấy loại obitan?
Có 4 loại obitan chính: s, p, d và f.
-
Hình dạng của obitan s là gì?
Orbitan s có hình cầu.
-
Orbitan p có mấy obitan con?
Orbitan p có 3 obitan con: px, py và pz.
-
Orbitan nào có mức năng lượng thấp nhất?
Orbitan s có mức năng lượng thấp nhất.
-
Sự khác nhau giữa obitan và quỹ đạo là gì?
Quỹ đạo là đường đi xác định của electron (mô hình Bohr), còn obitan là vùng không gian xác suất tìm thấy electron (mô hình hiện đại).
-
Orbitan có ý nghĩa gì trong việc hình thành liên kết hóa học?
Orbitan nguyên tử xen phủ tạo thành obitan phân tử, nơi các electron được chia sẻ giữa các nguyên tử, tạo nên liên kết hóa học.
Các tình huống thường gặp câu hỏi về Orbitan
- Học sinh thường nhầm lẫn giữa obitan và quỹ đạo.
- Học sinh khó hình dung hình dạng của các obitan d và f.
- Học sinh chưa hiểu rõ mối liên hệ giữa obitan và liên kết hóa học.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
- Cấu hình electron là gì?
- Liên kết hóa học là gì?
- Các loại liên kết hóa học?
Khi cần hỗ trợ hãy liên hệ Email: [email protected], địa chỉ: Mỹ Khê, Quận Hải Châu, Đà Nẵng, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.




