

Tóm Tắt Chương 5 Hóa 10 là nhu cầu thiết yếu của học sinh để nắm vững kiến thức nền tảng về cấu tạo nguyên tử. Chương này cung cấp cái nhìn sâu sắc về cấu trúc bên trong nguyên tử, từ hạt nhân đến lớp vỏ electron, mở đường cho việc hiểu các tính chất hóa học của các nguyên tố.
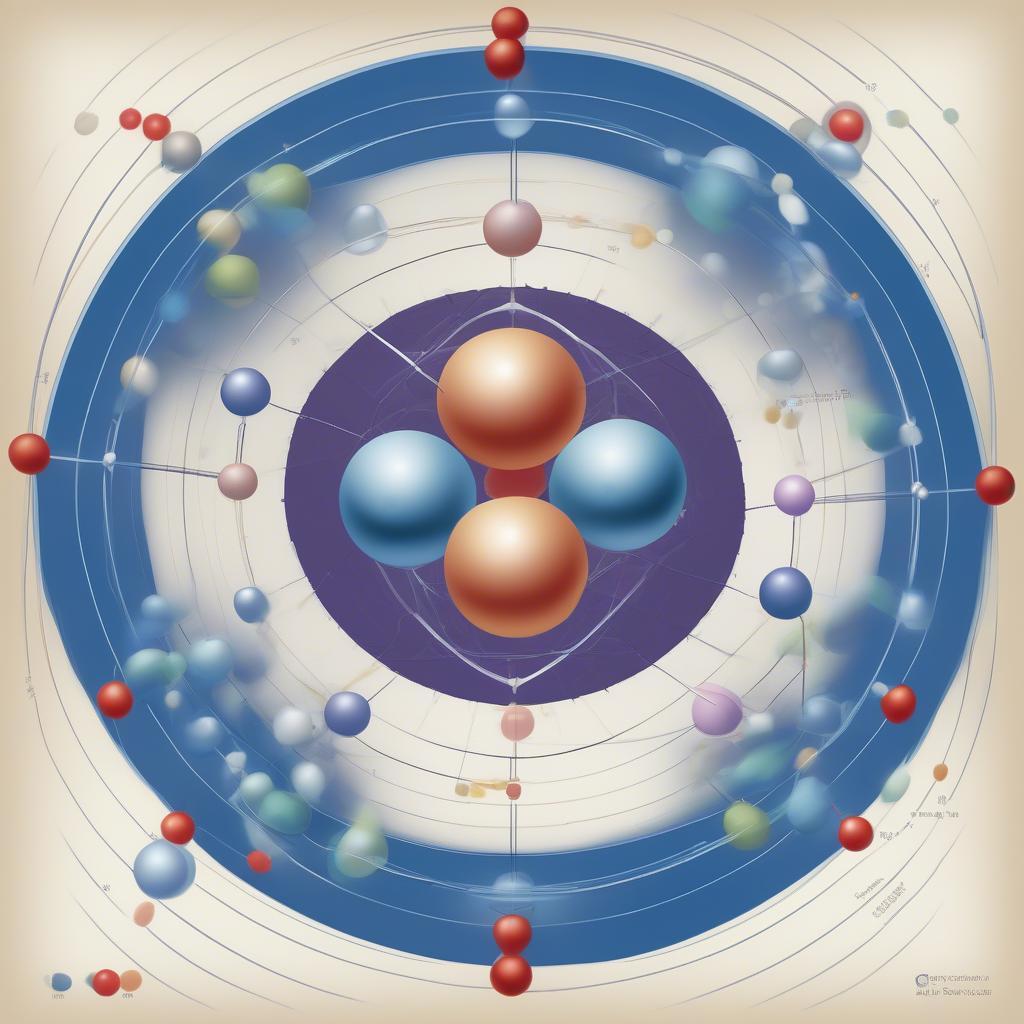 Cấu tạo nguyên tử với hạt nhân và electron
Cấu tạo nguyên tử với hạt nhân và electron
Hạt Nhân Nguyên Tử – Trung Tâm Của Vật Chất
Hạt nhân nguyên tử là phần trung tâm, chứa proton mang điện tích dương và neutron không mang điện. Số proton (ký hiệu là Z) quyết định nguyên tố hóa học, còn tổng số proton và neutron (ký hiệu là A) là số khối. Việc nắm vững kiến thức về hạt nhân giúp học sinh hiểu rõ hơn về đồng vị và khối lượng nguyên tử trung bình. Ví dụ, nguyên tố Carbon có Z=6, nghĩa là luôn có 6 proton. Tuy nhiên, số neutron có thể thay đổi, tạo ra các đồng vị khác nhau của Carbon.
tóm tắt lý thuyết hóa 10 chương 5
Đồng Vị Và Khối Lượng Nguyên Tử Trung Bình
Đồng vị là các nguyên tử của cùng một nguyên tố nhưng có số neutron khác nhau, dẫn đến số khối A khác nhau. Khối lượng nguyên tử trung bình được tính toán dựa trên khối lượng và tỷ lệ phần trăm của các đồng vị trong tự nhiên. Hiểu rõ khái niệm này rất quan trọng để giải quyết các bài tập tính toán liên quan.
Mô Hình Nguyên Tử Và Các Lớp Electron
Tóm tắt chương 5 hóa 10 không thể thiếu phần về mô hình nguyên tử và lớp vỏ electron. Mô hình nguyên tử hiện đại mô tả electron chuyển động trong các orbital, vùng không gian xung quanh hạt nhân mà xác suất tìm thấy electron là lớn nhất. Các orbital được sắp xếp thành các lớp và phân lớp electron, tuân theo quy tắc nhất định.
 Lớp electron của nguyên tử
Lớp electron của nguyên tử
Cấu Hình Electron Và Nguyên Lý Aufbau
Cấu hình electron cho biết sự phân bố electron trong các lớp và phân lớp. Nguyên lý Aufbau, nguyên lý Pauli và quy tắc Hund giúp xác định cấu hình electron của một nguyên tố. Cấu hình electron quyết định tính chất hóa học của nguyên tố, ví dụ như khả năng tạo liên kết hóa học.
GS. Nguyễn Văn A, chuyên gia hóa học, chia sẻ: “Việc nắm vững cấu hình electron là chìa khóa để hiểu sâu về tính chất hóa học của các nguyên tố.”
tóm tắt kiến thức hóa học 10 chương 5
Bảng Tuần Hoàn Và Sự Biến Đổi Tuần Hoàn
Chương 5 hóa 10 cũng giới thiệu về bảng tuần hoàn các nguyên tố hóa học, một công cụ hữu ích để sắp xếp và phân loại các nguyên tố dựa trên cấu hình electron và tính chất của chúng. Sự biến đổi tuần hoàn của các tính chất như bán kính nguyên tử, năng lượng ion hóa và độ âm điện được giải thích dựa trên cấu trúc nguyên tử.
tóm tắt kiến thức chương 5 6 hóa 10
Xu Hướng Biến Đổi Của Các Tính Chất Tuần Hoàn
Tóm tắt chương 5 hóa 10 cần làm rõ xu hướng biến đổi của các tính chất tuần hoàn. Ví dụ, bán kính nguyên tử tăng dần từ trên xuống dưới trong một nhóm và giảm dần từ trái sang phải trong một chu kỳ. Hiểu rõ xu hướng này giúp dự đoán tính chất của các nguyên tố.
 Bảng tuần hoàn các nguyên tố hóa học
Bảng tuần hoàn các nguyên tố hóa học
Kết luận
Tóm tắt chương 5 hóa 10 cung cấp kiến thức nền tảng về cấu tạo nguyên tử, từ hạt nhân đến lớp vỏ electron, và sự biến đổi tuần hoàn các tính chất. Nắm vững kiến thức này là bước đệm quan trọng để học tốt hóa học ở các lớp tiếp theo.
FAQ
- Proton và neutron khác nhau như thế nào?
- Cấu hình electron là gì?
- Nguyên lý Aufbau là gì?
- Bảng tuần hoàn được sắp xếp như thế nào?
- Độ âm điện là gì?
- Làm thế nào để tính khối lượng nguyên tử trung bình?
- Đồng vị là gì?
Mô tả các tình huống thường gặp câu hỏi.
Học sinh thường gặp khó khăn trong việc xác định cấu hình electron, tính toán khối lượng nguyên tử trung bình và áp dụng các nguyên lý để giải thích xu hướng biến đổi tuần hoàn.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về các bài tập vận dụng kiến thức chương 5 tại tóm tắt kiến thức hóa học 10 chương 5 6.




