

Tóm Tắt Kiến Thức Hóa Học 10 Chương 5 6 là việc hệ thống lại những nội dung trọng tâm về nhiệt hóa học và tốc độ phản ứng, giúp học sinh nắm vững kiến thức, tự tin làm bài tập và đạt điểm cao trong các kỳ thi. Bài viết này sẽ cung cấp cho bạn một cái nhìn tổng quan và chi tiết về các khái niệm, nguyên lý quan trọng trong hai chương này.
Nhiệt Hóa Học (Chương 5)
Nhiệt hóa học nghiên cứu sự thay đổi năng lượng dưới dạng nhiệt trong các phản ứng hóa học. Hiểu rõ về enthalpy, entropy và năng lượng tự do Gibbs sẽ giúp bạn dự đoán khả năng xảy ra phản ứng.
Enthalpy (ΔH)
Enthalpy là tổng năng lượng bên trong của hệ và tích của áp suất và thể tích. Phản ứng tỏa nhiệt (ΔH < 0) giải phóng nhiệt ra môi trường, trong khi phản ứng thu nhiệt (ΔH > 0) hấp thụ nhiệt từ môi trường.
- Enthalpy tạo thành tiêu chuẩn (ΔHfo): Nhiệt lượng tỏa ra hoặc thu vào khi tạo thành 1 mol chất từ các đơn chất ở trạng thái bền nhất, ở điều kiện tiêu chuẩn.
- Định luật Hess: Sự thay đổi enthalpy của một phản ứng chỉ phụ thuộc vào trạng thái ban đầu và trạng thái cuối cùng của phản ứng, không phụ thuộc vào con đường phản ứng.
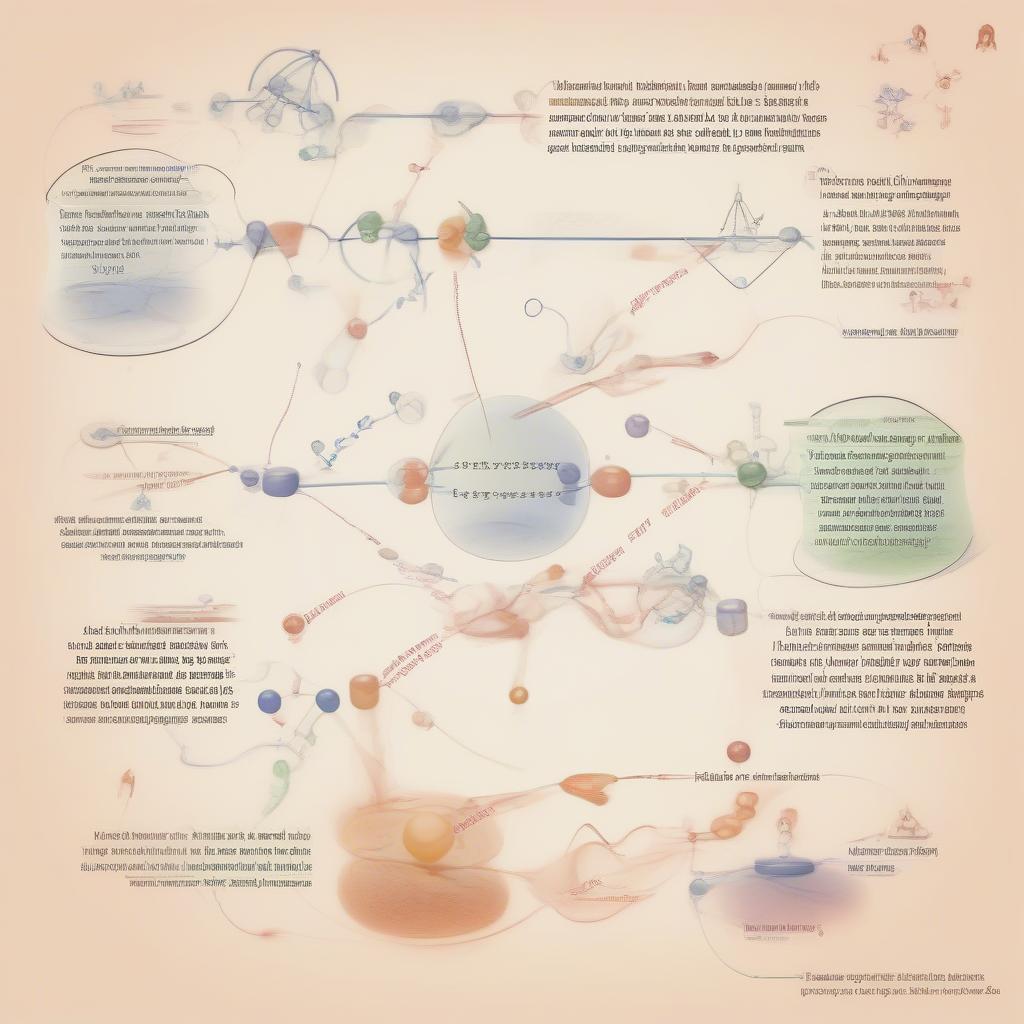 Định luật Hess Hóa 10
Định luật Hess Hóa 10
Entropy (ΔS)
Entropy là thước đo độ hỗn loạn của hệ. Phản ứng có ΔS > 0 làm tăng độ hỗn loạn của hệ.
Năng Lượng Tự Do Gibbs (ΔG)
Năng lượng tự do Gibbs (ΔG) cho biết khả năng tự diễn biến của phản ứng ở điều kiện nhiệt độ và áp suất không đổi. Nếu ΔG < 0, phản ứng tự diễn biến. Nếu ΔG > 0, phản ứng không tự diễn biến.
ΔG = ΔH – TΔS
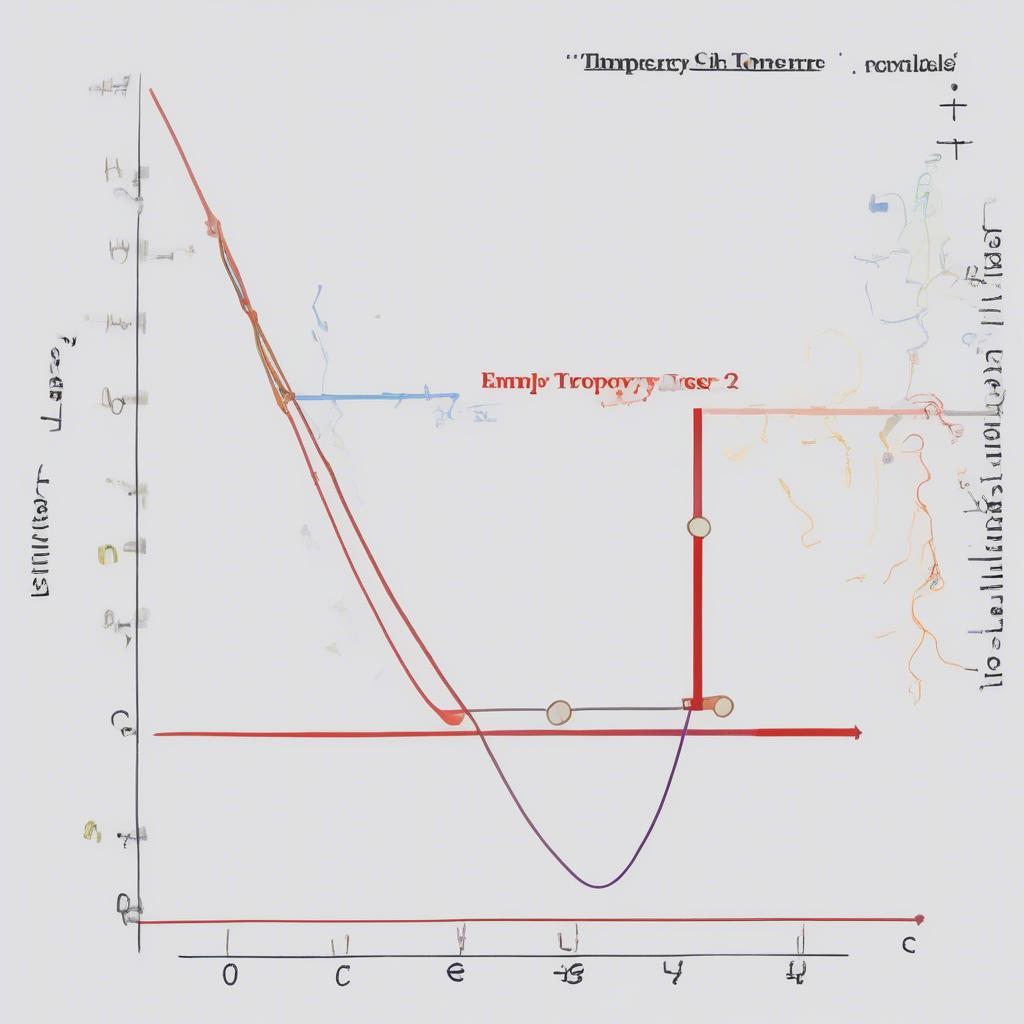 Năng lượng tự do Gibbs Hóa 10
Năng lượng tự do Gibbs Hóa 10
Tốc Độ Phản Ứng (Chương 6)
Tốc độ phản ứng là sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
Các Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng
- Nồng độ: Nồng độ chất phản ứng càng cao, tốc độ phản ứng càng nhanh.
- Nhiệt độ: Nhiệt độ càng cao, tốc độ phản ứng càng nhanh.
- Diện tích bề mặt: Diện tích bề mặt chất phản ứng càng lớn, tốc độ phản ứng càng nhanh.
- Chất xúc tác: Chất xúc tác làm tăng tốc độ phản ứng mà không bị biến đổi sau phản ứng.
Năng Lượng Hoạt Hóa (Ea)
Năng lượng hoạt hóa là năng lượng tối thiểu cần thiết để phản ứng xảy ra.
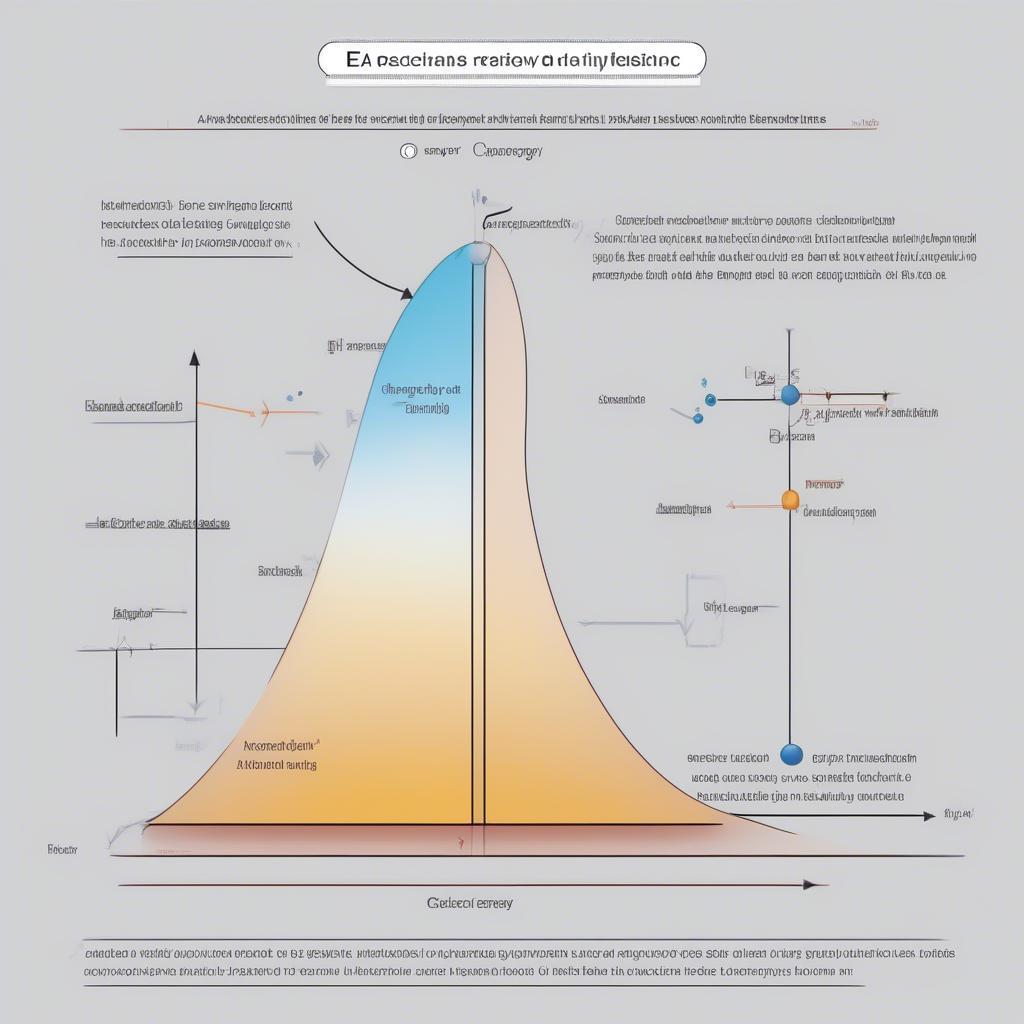 Năng lượng hoạt hóa Hóa 10
Năng lượng hoạt hóa Hóa 10
Kết Luận
Tóm tắt kiến thức Hóa học 10 chương 5 6 bao gồm những khái niệm quan trọng về nhiệt hóa học và tốc độ phản ứng. Nắm vững những kiến thức này sẽ giúp bạn hiểu rõ hơn về bản chất của các phản ứng hóa học và áp dụng vào giải quyết các bài tập.
FAQ
- Làm thế nào để tính ΔH của phản ứng?
- Ý nghĩa của ΔG là gì?
- Tại sao nhiệt độ ảnh hưởng đến tốc độ phản ứng?
- Chất xúc tác hoạt động như thế nào?
- Làm thế nào để xác định bậc của phản ứng?
- Sự khác biệt giữa phản ứng tỏa nhiệt và phản ứng thu nhiệt là gì?
- Làm thế nào để tính tốc độ phản ứng trung bình?
Mô tả các tình huống thường gặp câu hỏi.
Học sinh thường gặp khó khăn trong việc áp dụng định luật Hess để tính toán ΔH, phân biệt giữa ΔG và ΔH, và hiểu rõ về cơ chế hoạt động của chất xúc tác.
Gợi ý các câu hỏi khác, bài viết khác có trong web.
Bạn có thể tìm hiểu thêm về các dạng bài tập liên quan đến nhiệt hóa học và tốc độ phản ứng, cũng như các bài giảng chi tiết hơn về từng phần kiến thức trong chương 5 và 6 trên Đại CHiến 2.




